Вариант 12
Часть 1.
Ответом к заданиям 1–26 является последовательность цифр. Цифры в ответах на задания 5, 10–12, 18, 19, 22–26 могут повторяться.
1) Na 2) Н 3) F 4) Li 5) С
Определите, атомам каких из указанных в ряду элементов до завершения слоя не хватает одного электрона. Запишите в поле ответа номера выбранных элементов.
1) Na 2) Н 3) F 4) Li 5) С
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
1) Na 2) Н 3) F 4) Li 5) С
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях проявляют только положительную степень окисления. Запишите в поле ответа номера выбранных элементов.
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная неполярная химическая связь.
1. Са
2. Н2
3. АlСl3
4. HClO4
5. Cl2
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Аl(ОН)3
Б) Сu(ОН)2
В) ZnO
КЛАСС/ГРУППА
1) основание
2) оксид основный
3) оксид амфотерный
4) гидроксид амфотерный
Из предложенного перечня веществ выберите два металла, действием которых на раствор сульфата меди(II) можно получить медь.
1. натрий
2. серебро
3. кальций
4. цинк
5. железо
Из предложенного перечня выберите два оксида, которые реагируют с оксидом натрия.
1. P2O5
2. SO3
3. СаО
4. MgO
5. Li2O
В пробирку с раствором вещества X добавили несколько капель соли Y. В результате реакции наблюдали выделение белого не исчезающего при перемешивании осадка. Из предложенного перечня выберите два вещества, которые могут вступать в описанную реакцию.
1. КОН
2. НСl
3. CuSO4
4. Al(NO3)3
5. Mg(NO3)2
В заданной схеме превращений
[math]Al_2S_3\xrightarrow XH_2S\xrightarrow YSO_2[/math]
веществами X и Y соответственно являются:
1. Ca
2. NaOH
3. H2O
4. NH3
5. O2
Установите соответствие между уравнением реакции и изменением степени окисления окислителя в данной реакции. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ
А) 2NH3 + 2Na = 2NaNH2 + Н2
Б) 2НСl + 2К = 2КСl + Н2
В) 4NH3 + 6NO = 5N2 + 6Н2O
Г) 2H2S + 3O2 = 2SO2 + 2Н2O
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
1) -1 → 0
2) 0 → -1
3) +2 → 0
4) + 1 → 0
5) +4 → +2
6) 0 → -2
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Cl2
Б) SiO2
В) K2CO3
Г) Fe2(SO4)3
РЕАГЕНТЫ
1) HF, NaOH, СаO
2) НСl, Аl2O3, СаСl2
3) LiOH, KI, ВаСl2
4) H2SO4, O2, СO2
5) Mg, H2S, Н2
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) метилацетат
Б) метилэтиловый эфир
В) метиловый эфир муравьиной кислоты
КЛАСС/ГРУППА
1) простой эфир
2) сложный эфир
3) альдегид
4) углевод
Из предложенного перечня выберите два вещества, которые являются структурными изомерами метилциклопентана.
1. циклопентан
2. циклогексен
3. 2,3-диметилбутен-2
4. гексен-2
5. этилциклопентан
Из предложенного перечня выберите два вещества, которые реагируют с аммиачным раствором оксида серебра.
1. бутин-1
2. толуол
3. бутен-2
4. стирол
5. пропин
Из предложенного перечня выберите два вещества, с которыми реагирует пропанол-1.
1. K
2. H2
3. NaOH
4. KHCO3
5. HCOOH
Из предложенного перечня выберите два вещества, с которыми реагирует аланин.
1. пропан
2. метилэтиловый эфир
3. сульфат натрия
4. гидрокарбонат натрия
5. соляная кислота
Задана следующая схема превращений веществ:
[math]C_2H_4\xrightarrow XC_2H_5OH\xrightarrow YC_2H_5ONa[/math]
Определите, какие из указанных веществ являются веществами X и Y.
1. Na
2. NaHCO3
3. Na2CO3
4. H2O
5. Cu(OH)2
Установите соответствие между углеводородом и продуктом, который преимущественно образуется при его взаимодействии с хлороводородом в соотношении 1:1. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УГЛЕВОДОРОД
А) этилен
Б) пропин
В) циклобутан
Г) бутадиен-1,3
ПРОДУКТ РЕАКЦИИ
1) 2-хлорпропен
2) 1-хлорбутен-2
3) 1-хлорпропан
4) хлорэтан
5) 1-хлорбутан
6) 2-хлорбутен-1
Установите соответствие между веществом, которое вступает в реакцию с этанолом, и преимущественно образующимся углеродсодержащим продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) СuО
Б) KMnO4(H+)
В) Н2SO4 (конц. 180)
Г) K
ПРОДУКТ РЕАКЦИИ
1) ацетат калия
2) этилат калия
3) ацетальдегид
4) уксусная кислота
5) диметиловый эфир
6) этилен
Из предложенного перечня выберите два типа реакций, к которым можно отнести взаимодействие хлора с раствором иодида калия.
1. обмена
2. обратимая
3. замещения
4. каталитическая
5. окислительно-восстановительная
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости реакции обжига пирита.
1. понижение температуры
2. использовании катализатора
3. измельчение пирита
4. увеличение концентрации кислорода
5. уменьшение давления
Установите соответствие между формулой соли и продуктами электролиза её водного раствора, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) Mg(NO3)2
Б) КВr
В) СаСl2
Г) Hg(NO3)2
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) водород и кислород
2) металл и кислород
3) водород и галоген
4) металл и галоген
5) металл и водород
Установите соответствие между формулой соли и средой её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) NaCIO4
Б) АlСl3
В) K2SiO3
Г) К2СO3
СРЕДА РАСТВОРА
1) кислая
2) щелочная
3) нейтральная
Для системы С4Н8(г) + Н2(г) [math]\rightleftarrows[/math] С4Н10(г) + Q установите соответствие между изменением внешних условий и состоянием химического равновесия в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ИЗМЕНЕНИЕ ВНЕШНИХ УСЛОВИЙ
А) увеличения концентрации водорода
Б) повышения температуры
В) повышения давления
Г) использования катализатора
СОСТОЯНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) смещается в сторону прямой реакции
2) смещается в сторону обратной веществ
3) смещение равновесия не происходит
Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить их водные растворы: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛЫ ВЕЩЕСТВ
А) Nal и NaF
Б) ZnBr2 и MgBr2
В) КСl и НСl
Г) KF и HNO3
РЕАКТИВ
1) NaOH (р-р)
2) AgNO3(p-p)
3) H2SO4(p-p)
4) KCl(p-p)
5) NaHCO3
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) ацетилен
Б) этиленгликоль
В) пропан
Г) тринитроглицерин
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) в составе незамерзающих жидкостей
2) в качестве топлива
3) получение каучука
4) сварка и резка металлов
5) в качестве лекарственного средства
Смешали 250 г раствора с массовой долей соли 12% и 300 г раствора с массовой долей этой же соли 8%. Чему равна масса соли в полученном растворе? (Запишите число с точностью до десятых.)
Ответ: ______________г
Определите объём (н.у.) водорода, который теоретически необходим для синтеза 200 л (н.у.) хлороводорода из простых веществ. (Запишите число с точностью до целых.)
Ответ: _____________ л
Определите объём (н.у.) водорода, который можно получить при взаимодействии 0,5 моль магния с избытком разбавленной серной кислоты. (Запишите число с точностью до десятых.)
Ответ: ______________ л
Часть 2.
Запишите сначала номер задания (30, 31 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции:
Fe(OH)3 + Вr2 + ... → K2FeO4 + ... + Н2O
Определите окислитель и восстановитель.
1) Составлен электронный баланс:
[math]2\;\vert\;Fe^{+3}-3\overline e\rightarrow Fe^{-6}[/math]
[math]3\;\vert\;Br_2^0+2\overline e\rightarrow2Br^{-1}[/math]
2) Указано, что Fe(OH)3 (за счёт железа в степени окисления +3) является восстановителем, а бром в степени окисления 0 - окислителем.
3) Определены недостающие вещества, и расставлены коэффициенты в уравнении реакции:
2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6КВr + 8Н2O
Иодоводородную кислоту нейтрализовали гидрокарбонатом калия. Полученная соль прореагировала с раствором, содержащим дихромат калия и серную кислоту. При взаимодействии образовавшегося простого вещества с алюминием получили соль. Эту соль растворили в воде и смешали с раствором сульфида калия, в результате чего образовался осадок и выделился газ. Напишите уравнения четырёх описанных реакций.
1) КНСO3 + HI = KI + Н2O + CO2↑
2) К2Сr2O7 + 6KI + 7H2SO4 = Cr2(SO4)3 + 3I2 +
4K2SO4+ 7H2O
3) 2Al + 3I2 = 2AlI3
4) 2AlI3 + 3K2S + 6H2O = 2Аl(ОН)3| + 3H2S↑ + 6KI
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
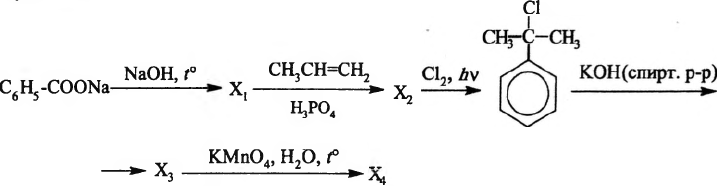
При написании уравнений реакций используйте структурные формулы органических веществ.
При взаимодействии 5,6 г гидроксида калия с 5,0 г хлорида аммония получили аммиак. Его растворили в 50 г воды. Определите массовую долю аммиака в полученном растворе. Определите объём 10%-ного раствора азотной кислоты с плотностью 1,06 г/мл, который потребуется для нейтрализации аммиака.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения физических величин).
1) Записаны уравнения реакций:
КОН + NH4Cl = КСl + NH3 + H2O
NH3 + HNO3 = NH4NO3
2) Рассчитаны количества вещества щёлочи и хлорида аммония, и сделан вывод об избытке щёлочи:
n(КОН) = 5,6 / 56 = 0,1 моль,
n(NH4Cl) = 5 / 53,5 = 0,093 моль - щёлочь в избытке, расчёт ведём по хлориду аммония.
3) Найдены масса аммиака и массовая доля его в растворе: n(NH3) = n(NH4Cl) = 0,093 моль
m(NH3) = 0,093 • 17 = 1,58 г
w(NH3) = 1,58 / 51,58 = 0,0306, или 3,06%
4) Рассчитан объём раствора кислоты: n(HNO3) = n(NH3) = 0,093 моль
m(HNO3) = 0,093 • 63 = 5,86 г
m(p-pa HNO3) = 5,86 / 0,1 = 58,6 г
V(HNO3) = 58,6 / 1,06 = 55,3 мл
При сгорании 17,5 г органического вещества получили 28 л (н.у.) углекислого газа и 22,5 мл воды. Плотность паров этого вещества (н.у.) составляет 3,125 г/л. Известно также, что это вещество было получено в результате дегидратации третичного спирта.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции получения данного вещества дегидратацией соответствующего третичного спирта.
Общая формула вещества - СхНуOz
1) Найдены количество вещества углекислого газа, воды и органического вещества:
n(СO2) = 28 / 22,4 = 1,25 моль
n(Н2O) = 22,5 / 18 = 1,25 моль
M(СхНуОz) = 3,125 • 22,4 = 70 г/моль
n(CxHyOz) = 17,5 / 70 = 0,25 моль
2) Определена молекулярная формула вещества:
n(С) = n(СO2) = 1,25 моль
n(Н) = 2n(Н2O) = 2,5 моль
х = n(C) / n(CxHyOz) = 1 * 25 / 0,25 = 5
у = n(Н) / n(СхНуОz) = 2,5 / 0,25 = 10 5 • 12 + 10 + z • 16 = 70
z = 0
Молекулярная формула вещества - С5Н10
3) Составлена структурная формула вещества:
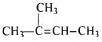
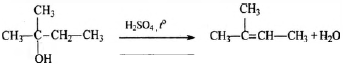
4) Составлено уравнение реакции получения вещества из третичного спирта:
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||