Вариант 27
Часть 1.
При выполнении заданий 1–15 укажите только одну цифру, которая соответствует номеру правильного ответа.
В атоме серы распределение электронов по электронным слоям соответствует ряду чисел
1) 8; 6; 2
2) 3; 6; 16
3) 2; 6; 8
4) 2; 8; 6
В каком ряду химические элементы расположены в порядке усиления неметаллических свойств?
1) Si → S → Сl
2) О → S → Se
3) N → Р → As
4) S → Р → Si
Одинаковый вид химической связи имеют алмаз и
1) карбид кальция
2) хлороводород
3) красный фосфор
4) вода
В каких соединениях атомы азота и фосфора имеют одинаковое значение степени окисления?
1) NH3 и РСl3
2) NH4OH и Mg3P2
3) NO2 и Н3РO4
4) NO2 и Р2О3
К основным оксидам относится
1) оксид азота(V)
2) оксид железа(III)
3) оксид алюминия
4) оксид меди(II)
Сумма коэффициентов в уравнении реакции каталитического окисления аммиака равна
1) 13
2) 15
3) 19
4) 7
Наибольшее количество хлорид-ионов образуется при диссоциации 1 моль
1) КСl
2) Са(СlO)2
3) КСlO4
4) СrСl3
При добавлении раствора карбоната натрия к раствору бромоводородной кислоты
1) выпадает осадок
2) выделяется газ
3) выпадает осадок и выделяется газ
4) видимых изменений не происходит
Какие вещества образуются при взаимодействии железа с разбавленной серной кислотой?
1) сульфат железа(III), вода и оксид серы(IV)
2) сульфат железа(II) и водород
3) сульфит железа(III) и водород
4) сульфид железа(II) и водород
Оксид кальция взаимодействует с
1) СuО
2) CO2
3) NaOH
4) FeCl2
Раствор соляной кислоты реагирует с каждым из двух веществ:
1) AgNO3 и Сu(ОН)2
2) Сu и СO2
3) MgO и НВг
4) ВаВг2 и SO2
При взаимодействии 1 моль H2SO4 и 2 моль NaOH образуется
1) средняя соль
2) основная соль
3) кислая соль
4) вещества не реагируют
Верны ли следующие суждения о способах очистки веществ?
А. Отделить бензин от воды можно с помощью делительной воронки.
Б. Разделить смесь воды, песка и сахара можно с помощью ректификации.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
В реакции, схема которой
НВr + СrO3 → Вr2 + СrВг3 + Н2O,
окислителем является
1) Сr+3
2) Br-
3) Сr+6
4) H+
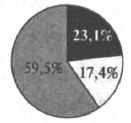
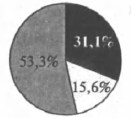
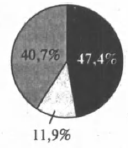
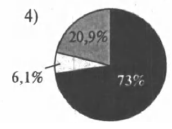
На какой диаграмме распределение массовых долей элементов отвечает качественному составу нитрата железа(III)?
1) 
2) 
3) 
4) 
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
Щёлочно-земельные металлы характеризует следующие признаки:
1) радиус атома уменьшается с увеличением атомной массы элементов
2) гидроксиды проявляют щелочные свойства
3) образуют гидриды ЭН2
4) имеют несколько степеней окисления
5) с увеличением порядкового номера ослабевают металлические свойства
Этилен характеризует следующее:
1) в молекуле содержится 2 атома углерода и 6 атомов водорода
2) молекула имеет плоскую форму
3) валентный угол равен 120°
4) не присоединяет водород и хлор
5) при гидратации образует уксусную кислоту
При выполнении заданий 18, 19 к каждому элементу первого первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
ВЕЩЕСТВА
А) HCl(р-р) и КОН(р-р)
Б) HCl(р-р)) и Na2SO4(р-р)
В) NaOH(р-р) и Ва(ОН)2(р-р)
РЕАКТИВ
1) лакмус(р-р)
2) NaOH(р-р)
3) H2SO4(р-р)
4) HNO3(р-р)
Установите соответствие между названием вещества и формулами реагентов, с которыми оно может взаимодействовать.
НАЗВАНИЕ ВЕЩЕСТВА
А) сера
Б) фосфор
В) хлор
ФОРМУЛЫ РЕАГЕНТОВ
1) H2S, KNO3
2) SO3, С2Н6
3) СН4, Zn
4) Hg, H2SO4(p-p)
5) O2, Cl2
Часть 2.
Для ответов на задания 20—22 используйте отдельный лист. Запишите сначала номер задания (20, 21, 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
CuSO4 + Nal —> Cul + Na2SO4 + I2.
Определите окислитель и восстановитель.
Cu+2SO4 + Nal- → Cu+1I +Na2SO4
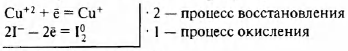 + [math]I_2^0[/math]
+ [math]I_2^0[/math]
2Cu+2 + 2I- = 2Сu+ + [math]I_2^0[/math]
Cu+2(Cu+2SO4) — окислитель
I-(NaI-) — восстановитель
Молекулярное уравнение
2CuSO4 + 4NaI = 2CuI + 2Na2SO4 + I2
Аммиак объёмом 4,48 л (н.у.) подвергли окислению кислородом в присутствии катализатора. Определите массу азотсодержащего продукта реакции.
1) Уравнение реакции:
4NH3 + 5O2 = 4NO↑ + 6H2O.
2) Рассчитываем количество вещества аммиака:
n(NH3) = 4,48/22,4 = 0,2 моль
3) Рассчитываем массу NO:
по уравнению реакции n(NO) = n(NH3) = 0,2 моль
M(NO) = 30 г/моль, m(NO) = 0,2 • 30 = 6 г.
Даны вещества: Na2S, Са(ОН)2, КМnO4, Na2SO3, H2SO4, НCl. Используя воду и необходимые вещества только из этого списка, получите в две стадии сульфат марганца(Н). Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
Схема эксперимента
Na2SO3 → SO2 → MnSO4
1) Na2SO3 + 2HCl = 2NaCl + H2O + SO2↑
2H+ + [math]SO_3^{2-}[/math] = H2O + SO2
Вьделяется бесцветный газ с резким запахом. Реакция ионного обмена.
2) 5SO2 + 2КМnO4 + 2Н2O = K2SO4 + 2MnSO4 + 2H2SO4
<!—dle_image_begin:/uploads/myimg/1471244304.png|—><!—dle_image_begin:/uploads/myimg/1471244304.png|—><!—dle_image_begin:/uploads/myimg/1471244304.png|—><!—dle_image_begin:/uploads/myimg/1471244304.png|—> <!—dle_image_end—><!—dle_image_end—><!—dle_image_end—><!—dle_image_end—>
<!—dle_image_end—><!—dle_image_end—><!—dle_image_end—><!—dle_image_end—>
5S+4 + 2Mn+7 = 5S+6 + 2Mn+2
Mn+7(KMnO4) — окислитель
S+4(SO2) — восстановитель
Раствор перманганата калия обесцвечивается. Реакция окислительно-восстановительная.
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||