Вариант 17
Часть 1.
При выполнении заданий 1–15 укажите только одну цифру, которая соответствует номеру правильного ответа.
У атомов [math]{}_{13}^{27}Al[/math] и [math]{}_{14}^{28}Si[/math] одинаковое число
1) нейтронов в ядре
2) валентных электронов
3) протонов в ядре
4) электронов в атоме
Высшая степень окисления в ряду химических элементов
азот → кислород → фтор
1) увеличивается
2) не изменяется
3) уменьшается
4) изменяется периодически
Ионная связь не характерна для соединения, образованного атомами
1) кальция и серы
2) натрия и йода
3) фосфора и брома
4) бария и фтора
В каком соединении степень окисления азота равна +3?
1) Na3N
2) NH4Cl
3) NH3
4) HNO2
Основанием и кислотой соответственно являются
1) HNO3 и NH4Al(SO4)2
2) H2S и NaNO3
3) H2SO3 и Са(ОН)2
4) КОН и Н4Р2O7
В реакцию разложения, протекающую без изменения степени окисления, вступает
1) NH4Cl
2) HgO
3) Cu(NO3)2
4) КСlO3
К электролитам относится каждое из двух веществ:
1) гидроксид калия (р-р) и ацетат натрия (р-р)
2) оксид железа(III) и уксусная кислота (р-р)
3) хлорид бария (р-р) и фруктоза (р-р)
4) этанол (р-р) и карбонат кальция
Газ выделяется при взаимодействии водных растворов
1) MgCl2 и Ba(NO3)2
2) Na2CO3 и СаСl2
3) NH4Cl и NaOH
4) CuSO4 и КОН
Непосредственно не взаимодействуют
1) кремний и фосфорная кислота
2) магний и азот
3) угарный газ и кислород
4) хлор и гидроксид калия
Оксид цинка реагирует с каждым веществом пары
1) К2O и Н2O
2) HNO3 и СO2
3) SiO2 и Сu
4) NaOH и HNO3
В реакцию с раствором гидроксида бария вступает
1) сульфат калия
2) сульфид меди(II)
3) медь
4) азот
Карбонат калия в растворе взаимодействует со всеми веществами в ряду
1) LiCl, Na2HPO4, СаСl2
2) СО, SO3, НСl
3) СO2, HCl, NaHSO4
4) Na2SiO3, Sr(NO3)2, КОН
Верны ли суждения о способах разделения смесей?
А. Выпаривание относят к физическим способам разделения смесей.
Б. Разделение смеси воды и этанола возможно способом фильтрования.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Процессу восстановления соответствует схема
1) H2O2 → O2
2) СlO- → Сl2
3) NH3 → NH4+
4) СО → СO2
Массовая доля натрия в пероксиде натрия равна
1) 41,82%
2) 58,97%
3) 74,19%
4) 32,39%
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
В ряду химических элементов Р → Аl → Na:
1) уменьшается электроотрицательность
2) увеличиваются заряды ядер атомов
3) ослабевают неметаллические свойства
4) уменьшаются радиусы атомов
5) увеличивается число заполненных электронных слоёв атомов
Стеариновая кислота
1) имеет в молекуле 18 атомов углерода
2) преимущественно входит в состав твёрдых жиров
3) используется в производстве синтетических моющих средств
4) относится к высшим непредельным карбоновым кислотам
5) при обычных условиях является жидкостью, мало растворимой в воде
При выполнении заданий 18, 19 к каждому элементу первого первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
ВЕЩЕСТВА
А) FeSO4 и Na2SO4
Б) СO2 и O2
В) NaCl и NaBr
РЕАКТИВ
1) Са(ОН)2
2) СuО
3) ВаСl2
4) AgNO3
Установите соответствие между исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВА
А) CuSO4 + NaOH →
Б) Cu(OH)2 + H2SO4 →
В) CuSO4 + ВаСl2 →
ПРОДУКТЫ РЕАКЦИИ
1) Н2O + CuSO4
2) CuCl2 + BaSO4
3) Na2SO4 + Cu(OH)2
4) CuCl + BaSO4
Часть 2.
Для ответов на задания 20—22 используйте отдельный лист. Запишите сначала номер задания (20, 21, 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
Са(СlO)2 + Na2S + Н2O → СаСl2 + S + NaOH.
Определите окислитель и восстановитель.
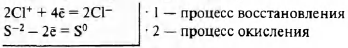 2Сl+ + 2S-2 = 2Сl- + 2SO
Сl+(Са(Сl+O)2 за счёт Сl+) — окислитель
S-2 (Na2S-2 за счёт S-2) — восстановитель
Молекулярное уравнение
Са(СlO)2 + 2Na2S + 2Н2О = СаСl2 + 2S + 4NaOH.
2Сl+ + 2S-2 = 2Сl- + 2SO
Сl+(Са(Сl+O)2 за счёт Сl+) — окислитель
S-2 (Na2S-2 за счёт S-2) — восстановитель
Молекулярное уравнение
Са(СlO)2 + 2Na2S + 2Н2О = СаСl2 + 2S + 4NaOH.Какой объём 12,6 %-ного раствора азотной кислоты плотностью 1,07 г/мл потребуется для растворения оксида меди(II) массой 16 г?
Даны вещества: Mg, АlСl3, CuS, растворы H2SO4, HNO3, NaOH. Используя воду и необходимые вещества только из этого списка, получите в две стадии оксид алюминия. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение.
Схема эксперимента АlСl3 → Аl(ОН)3 → Аl2O3
1) АlСl3 + 3NaOH = Аl(ОН)3↓ + 3NaCl
Аl3++ ЗОН- = Аl(ОН)3
Образуется объёмный осадок белого цвета. Реакция ионного обмена.
2) 2Аl(OН)3 = Аl2O3 + ЗН2O
Реакция разложения, протекающая без изменения степеней окисления. Изменяется структура осадка (становится более плотным).
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||