Вариант 13
Часть 1.
При выполнении заданий 1–15 укажите только одну цифру, которая соответствует номеру правильного ответа.
Число электронов во внешнем слое атома, ядро которого содержит 16 протонов, равно
1) 16
2) 3
3) 6
4) 2
В каком ряду химические элементы расположены в порядке усиления металлических свойств соответствующих им простых веществ?
1) калий → натрий → литий
2) магний → кальций → барий
3) натрий → магний→ алюминий
4) кальций → калий → натрий
Одинаковый вид химической связи имеют сульфид фосфоpa(V) и
1) фторид кислорода
2) сульфид натрия
3) азот
4) иодид бария
Степень окисления хлора в соединении NaClO3 равна
1) -1
2) +3
3) +5
4) +7
Основным оксидом и основной солью соответственно являются
1) FeO и FeSO4
2) СаО и СаСl2
3) ВаО и Ba(NO3)2
4) СаО и (СuOН)2СO3
К реакциям обмена и замещения соответственно относятся взаимодействие
1) серной кислоты с оксидом меди(II) и оксида натрия с оксидом углерода(IV)
2) соляной кислоты с магнием и натрия с водой
3) кальция с бромом и азотной кислоты с оксидом магния
4) соляной кислоты с гидроксидом железа(II) и магния с разбавленным раствором серной кислоты
При полной диссоциации 1 моль фосфата натрия в растворе образуется
1) 3 моль катионов натрия и 4 моль фосфат-ионов
2) 2 моль катионов натрия и 3 моль фосфат-ионов
3) 1 моль катионов натрия и 3 моль фосфат-ионов
4) 3 моль катионов натрия и 1 моль фосфат-ионов
При взаимодействии каких ионов в растворе не образуется газ?
1) Н+ и SO2-3
2) NH4+ и OH-
3) Н+ и ОН-
4) Н+ и СО2-3
Практически осуществима реакция
1) Ag + Na2O →
2) Fe + Н2 →
3) Аl + Fe3O4 →
4) Сu + Аl2O3 →
С оксидом железа(II) реагирует
1) NaCl
2) ВаО
3) НСl
4) Н2O
При взаимодействии серебра с концентрированной азотной кислотой преимущественно образуются
1) нитрат серебра(I), водород, вода
2) вещества не взаимодействуют
3) оксид азота(IV), нитрат серебра(I), вода
4) оксид азота(IV), нитрит серебра(I), вода
Какая схема соответствует правой части реакции разложения гидрокарбоната кальция при нагревании?
1) → СаО + Н2СO3
2) → СаСO3 + Н2O + СO2
3) → Са + СO2 + Н2O
4) → СаСО3 + Н2СO3
Верны ли суждения о химическом загрязнении окружающей среды и его последствиях?
А. Ионы тяжёлых металлов, содержащиеся в овощах, выращенных у дороги, никак не влияют на здоровье человека.
Б. Использование бензина, содержащего соединения свинца, отрицательно сказывается на состоянии окружающей среды и здоровье людей.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
В реакции нитрата меди(II) с железом окислителем является
1) Сu2+
2) Fe2+
3) N+5
4) О-2
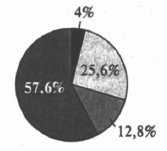
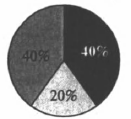
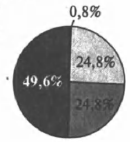
На какой диаграмме распределение массовых долей элементов отвечает количественному составу медного купороса?
1) 
2) 
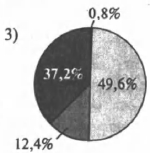
4) 
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
Для ряда химических элементов фтор → хлор → бром → йод характерны следующие закономерности изменения характеристик:
1) увеличение числа электронных слоёв
2) уменьшение числа электронов во внешнем слое
3) уменьшение окислительной способности
4) увеличение значения электроотрицательности
5) неизменность значения высшей степени окисления
Для этанола верны следующие утверждения:
1) в состав молекулы входит один атом углерода
2) атомы углерода в молекуле соединены двойной связью
3) является жидкостью (н.у.), хорошо растворяющейся в воде
4) вступает в реакцию со щелочными металлами
5) сгорает с образованием угарного газа и воды
При выполнении заданий 18, 19 к каждому элементу первого первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
ВЕЩЕСТВА
А) ВаСl2 и КОH
Б) Al(NO3)3 и Mg(NO3)2
В) K2SO4 и СаСl2
РЕАКТИВ
1) NaOH
2) Na2CO3
3) лакмус (р-р)
4) AgBr
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
НАЗВАНИЕ ВЕЩЕСТВА
А) сера
Б) оксид цинка
В) хлорид алюминия
РЕАГЕНТЫ
1) CO2, Na2SO4(р-р)
2) NaOH, P2O5
3) AgNO3, КОН(р-р)
4) H2SO4(конц.), O2
Часть 2.
Для ответов на задания 20—22 используйте отдельный лист. Запишите сначала номер задания (20, 21, 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
K2Cr2O7 + H2S + H2SO4 -> Cr2(SO4)3 + K2SO4 + S + H2O.
Определите окислитель и восстановитель.
K2Cr2+6O7 + H2S-2 + H2SO4 → Cr2+3(SO4)3 + K2SO4 + S0 + H2O
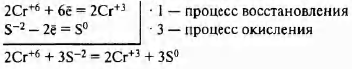
Сr+6 (К2Сr+62O7 за счёт Сr+6) — окислитель S-2 (H2S-2 за счёт S-2) — восстановитель
Молекулярное уравнение
К2Сr2O7 + 3H2S + 4H2SO4 = Cr2(SO4)3 + K2SO4 + 3S + 7H2O.
При добавлении 6,3 %-ного раствора азотной кислоты к оксиду меди(II) было получено 112,8 г соответствующей соли. Определите массу использованного раствора азотной кислоты.
1) Уравнение реакции:
2HNO3 + CuO = Cu(NO3)2 + H2O
2) Рассчитываем количество вещества и массу HNO3:
а) количество вещества Cu(NO3)2
n = mв-ва / Mв-ва
M(Cu(NO3)2) = 188 г/моль;
n(Cu(NO3)2) = 112,8/188 = 0,6 моль
б) по уравнению реакции: n(HNO3) = 2n(Cu(NO3)2) = 1,2 моль
M(HNO3) = 63 г/моль;
m(HNO3) = 1,2 • 63 = 75,6 г
3) Рассчитываем массу раствора HNO3:
ω = mв-ва / mр-ра
mр-ра (HNO3) = 75,6 • 100 / 6,3 = 1200 г.
Даны вещества: KCl, MnO2, MgO, КОН, НСl, Zn. Используя воду и необходимые вещества только из этого списка, получите в две стадии хлорат калия. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение.
МnO2 → Сl2 → КСlO3
1) MnO, + 4НСl = MnCl2 + Cl2 + 2Н2O

Мn+4 + 2Сl-=Мn+2 + [math]Cl_2^0[/math]
Мn+4 (МnO2) — окислитель
Cl- (НСl) — восстановитель
Реакция окислительно-восстановительная. Выделяется ядовитый газ жёлто-зелёного цвета с характерным запахом.
2) ЗСl2 + 6КОН (горячий р-р) = 5КСl + КСlO3+ 3H2O

Сl0 + 5Сl0 = Сl+5 + 5Сl-
Сl0 (Сl2) — окислитель
Сl0 (Сl2) — восстановитель
Реакция окислительно-восстановительная.
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||