Вариант 7
Часть 1.
При выполнении заданий 1–15 укажите только одну цифру, которая соответствует номеру правильного ответа.
Во 2-м периоде VIA группе Периодической системы находится химический элемент, схема строения атома которого
1) 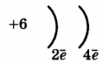
2) 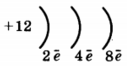
3) 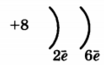
4) 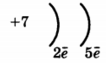
Номер группы в Периодической системе химических элементов Д.И. Менделеева соответствует
1) числу электронов в атоме
2) значению высшей валентности элемента по кислороду
3) числу электронов, недостающих до завершения внешнего электронного слоя
4) числу электронных слоев в атоме
Ионная химическая связь реализуется в
1) кристаллической сере
2) твёрдом иоде
3) иодиде кальция
4) оксиде фосфора(V)
Атом азота проявляет валентность, отличную от III, в молекуле
1) HNO3
2) HNO2
3) NF3
4) NH3
Только основные оксиды представлены в ряду
1) Na2O, СО
2) СаО, Аl2O3
3) BaO, Na2O
4) Р2O5, СаО
Признаком протекания реакции между магнием и раствором серной кислоты является:
1) изменение цвета
2) появление запаха
3) выделение газа
4) выпадение осадка
Хлорид-ионы образуются при растворении в воде вещества, формула которого:
1) НСIO
2) C2H5Cl
3) MgCl2
4) CCl4
Взаимодействию азотной кислоты и едкого калия отвечает краткое ионное уравнение
1) HNO3 + ОН = Н2O + NO3
2) Н+ + OН- = Н2O
3) Н+ + КОН = Н2O + К+
4) Н+ + NO3- + ОН- = Н2O + N3-
Натрий образует нитрат натрия при взаимодействии с
1) азотом
2) аммиаком
3) азотной кислотой
4) оксидом азота(I)
Оксид меди(II) взаимодействует с водным раствором
1) хлорида калия
2) хлороводорода
3) карбоната натрия
4) сульфата магния
С раствором гидроксида натрия реагирует
1) Р2O5
2) K2CO3
3) BaCO3
4) K3PO4
Нитрат меди(II) при нагревании разлагается с образованием
1) Cu
2) Cu3N2
3) Cu(NO2)2
4) CuO
Верны ли следующие суждения о способах собирания газов в лаборатории?
А. Углекислый газ можно собрать в сосуд способом вытеснения воздуха.
Б. Кислород можно собрать в сосуд и способом вытеснения воздуха, и способом вытеснения воды.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
В уравнении окислительно-восстановительной реакции
H2S + O2 → Н2O + SO2
коэффициент перед формулой восстановителя равен
1) 1
2) 2
3) 3
4) 4
Массовая доля кислорода в нитрате алюминия равна
1) 7,5%
2) 22,5%
3) 42,4%
4) 67,6%
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
Отличие магния и алюминия состоит в том, что
1) их атомы имеют три электронных слоя
2) значение их электроотрицательности меньше, чем у кремния
3) они оба образуют простые вещества металлы
4) им соответствуют высшие оксиды с формулой ЭО
5) у них одинаковые химические свойства
К карбоновым кислотам относятся вещества, формулы которых
1) С2Н5 — СОО — С3Н7
2) СН3СНО
3) HCOH
4) HCOOH
5) C3H7COOH
При выполнении заданий 18, 19 к каждому элементу первого первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. К каждому элементу первого столбца подберите соответствующий элемент второго столбца.
ВЕЩЕСТВА
А) AgNO3(p-p) и KNO3(p-p)
Б) Ва(ОН)2(р-р) и КОН(р-р)
В) К2СO3(р-р) и H2SO4(p-p)
РЕАКТИВ
1) лакмус
2) Cu
3) K2SO4 (p-p)
4) NaNO3(p-p)
Установите соответствие исходными веществами и продуктами реакции.
ИСХОДНЫЕ ВЕЩЕСТВА
А) AgNO3 + ВаСl2
Б) Ba(NO3)2 + H2SO4
В) Na2CO3 + НСl
ПРОДУКТЫ РЕАКЦИИ
1) Ba(NO3)2 + AgCl
2) BaSO4 + Н2
3) BaSO4 + HNO3
4) NaCl + H2O + C
5) NaCl + H20 + CO2
Часть 2.
Для ответов на задания 20—22 используйте отдельный лист. Запишите сначала номер задания (20, 21, 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
Zn + H2SO4(конц.) → ZnSO4 + H2S + H2O
Определите окислитель и восстановитель.
1. Составлен электронный баланс.
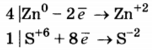
2. Расставлены коэффициенты в уравнении реакции:
4Zn + 5H2SO4(конц.) - 4ZnSO4 + H2S + 4H2O
3. Указано, что восстановителем является Zn0, а окислителем S+6.
В избытке соляной кислоты растворили 1,506 г руды, содержащей 77% карбоната железа(II). Определите объём углекислого газа, выделившегося при этом.
1) Уравнение реакции:
FeCO3 + 2HCl= FeCl2 + CO2↑ + H2O
2) Рассчитываем массу FeCO3(чист.):
m(FeCO3(чист.)) = ω(FeCO3) * m(руды) = 0,77 * 1,506 г ≈ 1,16 г
3) Рассчитываем количество вещества FeCO3(чист.):
n(FeCO3(чист.)) = m/M =1,16г/116г/моль = 0,01 моль
4) Рассчитываем объём CO2:
а) по уравнению реакции: n(CO2) = n(FeCO3(чист.)) = 0,01 моль
б) V(CO2) = n(CO2)*Vm = 0,01 моль * 22,4 л/моль = 0,224 л
Для проведения эксперимента предложены следующие реактивы: малахит, медь, карбонат натрия и растворы серной кислоты, гидроксида натрия. Вам также предоставлен комплект лабораторного оборудования, необходимый для проведения химических реакций.
Требуется получить гидроксид меди в результате проведения двух последовательных реакций. Выберите необходимые для этого реактивы из числа тех, которые вам предложены. Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций. Для первой реакции составьте сокращённое ионное уравнение.
Составлена схема превращений, в результате которой можно получить гидроксид меди:
1) (СuOН)2СO3 → CuSO4 → Сu(ОН)2 Составлены уравнения двух проведённых реакций
2) (CuOH)2CO3 + 2H2SO4 = 2СuSO4 + ЗН20 + СO2 ↑
3) CuSO4 + 2NaOH = Cu(OH)2 ↓ + Na2SO4
Составлено сокращённое ионное уравнение первой реакции:
4) (CuOH)2CO3 + 4Н+ = 2Сu2+ + ЗН2O + СO2 ↑
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||