Вариант 10
Проверочная работа включает в себя 15 заданий. На выполнение работы по химии отводится 1 час 30 минут (90 минут).
Из курса .химии вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация.
На рисунках 1—3 представлены ситуации, в которых применены указанные методы познания.

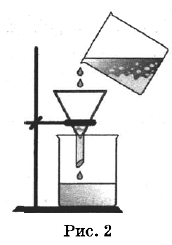
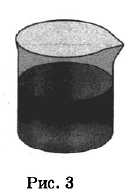
Какими из способов, которые показаны на рисунках, МОЖНО разделить смесь:
1) толчёного мрамора и активированного угля;
2) раствора нитрата натрия и осадка гидроксида меди(II);
3) этилового спирта и глицерина?
| Смесь | Номера рисунков, соответствующие способам разделения смесей, которые МОЖНО использовать |
| Толчёный мрамор и активированный уголь | |
| Осадок гидроксида меди(II) и раствор нитрата натрия | |
| Этиловый спирт и глицерин |
| Смесь | Номера рисунков, соответствующие способам разделения смесей, которые МОЖНО использовать |
| Толчёный мрамор и активированный уголь | 3 |
| Осадок гидроксида меди(II) и раствор нитрата натрия | 2 |
| Этиловый спирт и глицерин | 1 |
На рисунке изображена модель электронного строения атома некоторого химического элемента.
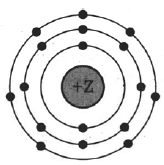
На основании анализа предложенной модели:
1) Определите заряд ядра Z;
2) Укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент;
3) Определите высшую возможную степень окисления элемента в соединениях.
| Символ химического элемента | № периода | № группы | Высшая степень окисления |
Периодическая система химических элементов Д.И. Менделеева — богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что лёгкость отдачи электронов атомами элементов в периодах с увеличением заряда ядра уменьшается, а в группах — возрастает.
Учитывая эти закономерности, расположите в порядке увеличения лёгкости отдачи электронов следующие элементы: В, С, N, Аl. Запишите обозначения элементов в нужной последовательности.
Ниже перечислены характерные свойства веществ, которые имеют молекулярное и атомное строение.
молекулярного строения
—при обычных условиях имеют жидкое, газообразное или твёрдое агрегатное состояние;
—имеют низкие значения температур кипения и плавления;
—имеют низкую теплопроводность.
ионного строения
—твёрдые при обычных условиях;
—хрупкие;
—тугоплавкие;
—нелетучие;
—не растворимы в воде, не проводят электрический ток.
Используя данную информацию, определите, какое строение имеют вещества: сульфид алюминия Al2S3 и белый фосфор Р4. Запишите ответ в отведённом месте.
1. Сульфид алюминия Al2S3
2. Белый фосфор Р4
Оксиды условно подразделяют на четыре группы, как показано на схеме. В эту схему для каждой из четырёх групп впишите пропущенные названия групп или химические формулы оксидов (по одному примеру формул), принадлежащих к данной группе.
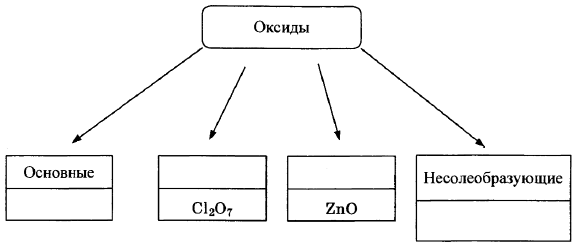
Элементы ответа:
Записаны названия групп: кислотные, амфотерные;
записаны формулы веществ соответствующих групп.
Аммиак (NH3) — одно из наиболее используемых в промышленности неорганических веществ.
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония. Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота.
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных электрона атома азота участвуют в образовании ковалентных связей с 1s-электронами трёх атомов водорода (связи N—Н), четвёртая пара внешних электронов является неподелённои. При нормальных условиях аммиак — бесцветный газ, легче воздуха, с резким характерным запахом (запах нашатырного спирта), хорошо растворим в воде, ядовит. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах.
Для аммиака характерны реакции как с изменением степени окисления атома азота (реакции окисления), так и без изменения степени окисления атома азота (например, присоединение хлороводорода).
1) Составьте молекулярное уравнение оговорённой в тексте реакции получения аммиака в промышленности.
2) Укажите, какая это химическая реакция — экзотермическая или эндотермическая, необратимая или обратимая.
1) N2 + ЗН2 ⇄ 2NH3
2) Это реакция экзотермическая, обратимая.
1) Составьте молекулярное уравнение оговорённой в тексте реакции, протекающей без изменения степени окисления азота.
2) Назовите получившийся при этом продукт.
1) NH3 + НСl = NH4Cl
2) Хлорид аммония
1) Составьте сокращённое ионное уравнение реакции, протекающее между хлоридом аммония и раствором гидроксида натрия при нагревании.
2) Объясните, какая реакция среды (кислая, нейтральная или щелочная) характерна для водного раствора аммиака.
1) NH4+ + ОН- = NH3 + Н2O
2) Водный раствор аммиака имеет щелочную реакцию среды
Дана схема окислительно-восстановительной реакции:
HIO3 + NO2 + Н2O → I2 + HNO3
1) Составьте электронный баланс для этой реакции.
2) Укажите окислитель и восстановитель.
3) Расставьте коэффициенты в уравнении реакции.
1) Составлен электронный баланс:

2) Указано,что окислителем является I+5 (или йодноватая кислота), восстановителем — N+4 (или диоксид азота);
3) Составлено уравнение реакции:
2НIO3 + 10NO2 + 4Н2O → I2 + 10HNO3
Дана схема превращений:
N2 → Mg3N2 → NH3 → NO
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
1) N2 + 3Mg = Mg3N2
2) Mg3N2 + 6Н2O = 3Mg(OH)2 + 2NH3↑
3) 
Установите соответствие между классом органических веществ и формулой его представителя: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
КЛАСС ВЕЩЕСТВА
А) глицин
Б) целлюлоза
В) триолеат глицерина
ФОРМУЛА ПРЕДСТАВИТЕЛЯ
1) ароматические амины
2) углеводы
3) аминокислоты
4) жиры
В предложенные схемы химических реакций вставьте формулы пропущенных веществ и расставьте коэффициенты.
1) С3Н8 + Вr2 → _____ + НВr
2) С5Н10+ O2 → _____ + Н2O
1) С3Н8 + Вг2 → С3Н7Вг + НВг
2) 2С5Н10 + 15O2 → 10СO2 + 10Н2O
Этиловый спирт широко используется в пищевой, косметической, парфюмерной и химической промышленности. Он применяется также как топливо, растворитель и антисептическое средство. Одним из способов его получения является брожение глюкозы С6Н12O6.
Какая масса спирта образовалась в результате брожения глюкозы, если при этом выделилось 11,2 л (н.у.) углекислого газа? Запишите подробное решение задачи.
1) Составлено уравнение реакции брожения глюкозы:
С6Н12O6 → 2С2Н5ОН + 2СО2
2) n(СO2) = 11,2 л /22,4 л/моль = 0,5 моль
n(С2Н5ОН) = n(СO2) = 0,5 моль
3) m(С2Н5ОН) = М • n = 46 г/моль • 0,5 моль = 23 г
Метиламин — простейший органический аналог аммиака. Его применяют для синтеза лекарственных средств, пестицидов и красителей. По приведенной ниже схеме составьте уравнения реакций, характеризующих химические свойства метиламина. В уравнениях используйте структурные формулы органических веществ.
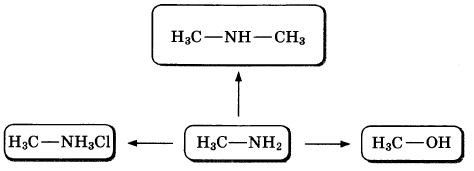
1)
2)
3)
Электролитом для зарядки автомобильных аккумуляторов служит 37%-ный раствор серной кислоты. Рассчитайте массу серной кислоты и массу воды, которые содержатся в 5 л электролита, плотность которого равна 1,28 г/мл. Запишите подробное решение задачи.
1) m(электролита) = V • р = 5000 л • 1,28 г/л = 6400 г
m(H2SO4) = m(электролита) • ω = 6400 г • 0,37 = 2368 г
2) m(Н2O) = 6400 г - 2368 г = 4032 г