Вариант 9
Проверочная работа включает в себя 15 заданий. На выполнение работы по химии отводится 1 час 30 минут (90 минут).
Из курса химии вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация.
На рисунках 1—3 представлены ситуации, в которых применены указанные методы познания.

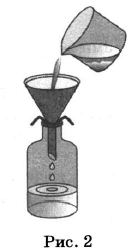
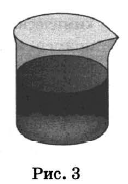
Какими из способов, которые показаны на рисунках, НЕЛЬЗЯ разделить смесь:
1) тетрахлорметана и диэтилового эфира;
2) бензола и глицерина;
3) раствора хлорида натрия и осадка сульфата бария?
| Смесь | Номер рисунка | Номера рисунков, соответствующие способам разделения смесей, которые НЕЛЬЗЯ использовать |
| Тетрахлорметан и диэтиловый эфир | ||
| Бензол и глицерин | ||
| Раствор хлорида натрия и осадок сульфата бария |
| Смесь | Номер рисунка | Номера рисунков, соответствующие способам разделения смесей, которые НЕЛЬЗЯ использовать |
| Тетрахлорметан и диэтиловый эфир | 2,3 | |
| Бензол и глицерин | 2,3 | |
| Раствор хлорида натрия и осадок сульфата бария | 1,3 |
На рисунке изображена модель электронного строения атома некоторого химического элемента.
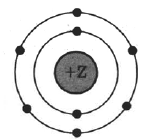
На основании анализа предложенной модели:
1) Определите заряд ядра Z.
2) Укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент.
3) Определите низшую возможную степень окисления элемента в соединениях.
| Символ химического элемента | № периода | № группы | Металл/неметалл |
Периодическая система химических элементов Д.И. Менделеева богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Например, известно, что кислотный характер бескислородных кислот с увеличением заряда ядра атома усиливается и в периодах, и в группах.
Учитывая эти закономерности, расположите в порядке усиления кислотных свойств водородные соединения: Н2O, HF, H2S, НСl. Запишите химические формулы в нужной последовательности.
Ниже перечислены характерные свойства веществ, которые имеют молекулярное и атомное строение.
молекулярного строения
—при обычных условиях имеют жидкое, газообразное или твёрдое агрегатное состояние;
—имеют низкие значения температур кипения и плавления;
—имеют низкую теплопроводность.
ионного строения
—твёрдые при обычных условиях;
—хрупкие;
—тугоплавкие;
—нелетучие;
—в расплавах и растворах проводят электрический ток.
Используя данную информацию, определите, какое строение имеют вещества: пропан С3Н8 и фторид кальция CaF2. Запишите ответ в отведённом месте.
1. Пропан С3Н8
2. Фторид кальция CaF2
Оксиды условно подразделяют на четыре группы, как показано на схеме. В эту схему для каждой из четырёх групп впишите пропущенные названия групп или химические формулы оксидов (по одному примеру формул), принадлежащих к данной группе.
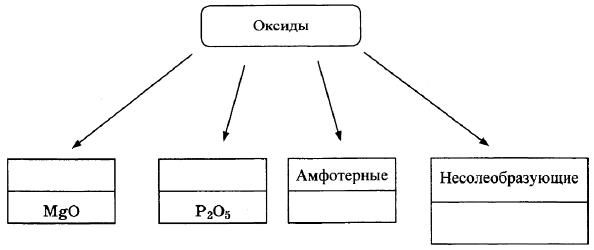
Записаны названия групп: основные, кислотные;
записаны формулы веществ соответствующих групп.
Углекислый газ (СO2) — газ без запаха и цвета, тяжелее воздуха, при сильном охлаждении кристаллизуется в виде белой снегообразной массы — «сухого льда». При атмосферном давлении он не плавится, а испаряется. Содержится в воздухе и в воде минеральных источников, выделяется при дыхании животных и растений. Растворим в воде (1 объём оксида углерода в одном объёме воды при 15 °С).
Степень окисления +4 для углерода является устойчивой, тем не менее углекислый газ может проявлять окислительные свойства, взаимодействуя, например, с магнием. По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует кислоту. Реагирует с щёлочами с образованием карбонатов и гидрокарбонатов.
Организм человека выделяет приблизительно 1 кг углекислого газа в сутки. Он переносится от тканей, где образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие.
В промышленных количествах оксид углерода(IV) выделяется из дымовых газов или в качестве побочного продукта химических процессов, например при разложении природных карбонатов (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, который поглощает оксид углерода(IV), переводя его в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая диоксид углерода.
В лабораторных условиях небольшие количества его получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора или соды с соляной кислотой в аппарате Киппа. Использование серной кислоты в данном случае менее желательно.
1) Составьте молекулярное уравнение оговорённой в тексте реакции взаимодействия оксида углеродa(IV) с магнием.
2) Во сколько раз оксид углерода(IV) тяжелее воздуха?
1) СO2 + 2Mg = 2MgO + С
2) Оксид углерода(IV) тяжелее воздуха в 44/29 = 1,5 раза.
1) Составьте молекулярное уравнение оговорённой в тексте реакции промышленного получения оксида углерода(IV) из известняка.
2) Не приводя уравнение реакции, объясните, на чём основано применение доломита (СаСO3 • MgCO3) в сельском хозяйстве для раскисления почв.

2) Доломит СаСO3 • MgCO3, будучи карбонатом, взаимодействует с почвенными кислотами, нейтрализуя их.
1) Составьте сокращённое ионное уравнение оговорённой в тексте реакции получения углекислого газа взаимодействием соляной кислоты с мрамором.
2) Объясните, почему нежелательно использование серной кислоты при получении оксида углерода(IV) в аппарате Киппа.
1) СаСO3 + 2Н+ = Са2+ + Н2O + СO2
2) В случае использования серной кислоты образец мрамора покрывается сверху слоем малорастворимого сульфата кальция, что препятствует протеканию реакции.
Дана схема окислительно-восстановительной реакции:
Fe(OH)2 + O2 + Н2O → Fe(OH)3
1) Составьте электронный баланс для этой реакции.
2) Укажите окислитель и восстановитель.
3) Расставьте коэффициенты в уравнении реакции.
1) Составлен электронный баланс:

2) Указано, что окислителем является кислород O2, восстановителем — Fe+2 (или гидроксид железа(II));
3) Составлено уравнение реакции:
4Fe(OH)2 + O2 + 2Н2O = 4Fe(OH)3
Дана схема превращений:
N2 → NH3 → NH4NO3 → NH3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
1) 
2) NH3 + HNO3 = NH4NO3
3) NH4NO3 + КОН = KNO3 + H2O + NH3↑
Установите соответствие между названием органического вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) глицерин
Б) 2-метилгексан
В) метаналь
КЛАСС / ГРУППА
1) предельные углеводороды
2) спирты
3) непредельные углеводороды
4) альдегиды
214
В предложенные схемы химических реакций вставьте формулы пропущенных веществ и расставьте коэффициенты.
1)NH3 + ____→ CH3COONH4
2) C6H6 + _____ → CO2 + Н2O
1) NH3 + СН3СООН → CH3COONH4
2) 2С6Н6 + 15O2 → 12СO2 + 6Н2O
Этиловый спирт широко используется в пищевой, косметической, парфюмерной и химической промышленности. Он применяется также как топливо, растворитель и антисептическое средство. Одним из способов его получения является брожение глюкозы С6Н12О6.
Какая масса глюкозы подверглась брожению, если при этом получено 138 г этилового спирта? Запишите подробное решение задачи.
1) Составлено уравнение реакции брожения глюкозы:
С6Н12O6 → 2С2Н5ОН + 2СO2
2) n(С2Н5ОН) = m/М =138 г/46 г/моль = 3 моль
n(С6Н12O6) = ½ • n(С2Н5ОН) = 1,5 моль
3) m(С6Н12O6) = М • n = 180 г/моль • 1,5 моль = 270 г
Анилин — простейший ароматический амин. Его используют для производства красителей, полиуретанов и искусственных каучуков. По приведённой ниже схеме составьте уравнения реакций, характеризующих химические свойства анилина. В уравнениях используйте структурные формулы органических веществ.
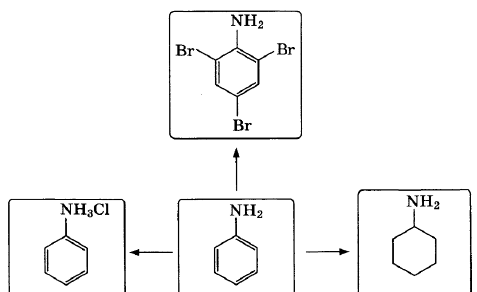
1)
2)
3)
Для лечения железодефицитной анемии в медицине используется хлорид железа(II). Рассчитайте, какую массу кристаллогидрата этой соли (FeCl2 * 6Н2O) следует взять для приготовления 300 г раствора с массовой долей хлорида железа 5%. Запишите подробное решение задачи.
1) m(FeCl2) — m(p-pa)•ω = 300 г • 0,05 = 15 г
n(FeCl2 • 6Н2O) = n(FeCl2) = m/М = 15 г/127 г/моль = 0,12 моль
2) m(FeCl2 • 6Н2O) = n • М = 0,12 моль • 235 г/моль = 28,2 г