Вариант 8
Проверочная работа включает в себя 15 заданий. На выполнение работы по химии отводится 1 час 30 минут (90 минут).
Из курса химии вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация.
На рисунках 1-3 представлены ситуации, в которых применены указанные методы познания.

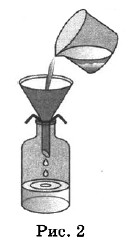

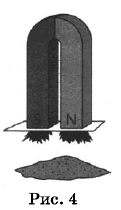
Какими из способов, которые показаны на рисунках, НЕЛЬЗЯ разделить смесь:
1) ацетона и бутанола-1;
2) глины и речного песка;
3) сульфата бария и ацетона?
| Смесь | Номера рисунков, соответствующие способам разделения смесей, которые НЕЛЬЗЯ использовать |
| Ацетон и бутанол-1 | |
| Глина и речной песок | |
| Сульфат бария и ацетон |
| Смесь | Номера рисунков, соответствующие способам разделения смесей, которые НЕЛЬЗЯ использовать |
| Ацетон и бутанол-1 | 1,2,4 |
| Глина и речной песок | 2,3,4 |
| Сульфат бария и ацетон | 4 |
На рисунке изображена модель электронного строения атома некоторого химического элемента.
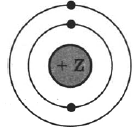
На основании анализа предложенной модели:
1) Определите химический элемент, атом которого имеет такое электронное строение.
2) Укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент.
3) Определите, к металлам или неметаллам относится простое вещество, образованное этим химическим элементом.
| Символ химического элемента | № периода | № группы | Металл/неметалл |
Периодическая система химических элементов Д.И. Менделеева богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Например, известно, что с увеличением порядкового номера химического элемента в периодах электроотрицательность атомов увеличивается, а в группах — уменьшается.
Учитывая эти закономерности, расположите в порядке уменьшения электроотрицательности следующие элементы: В, С, N, Аl. Запишите обозначения элементов в нужной последовательности.
Ниже перечислены характерные свойства веществ, которые имеют молекулярное и атомное строение.
молекулярного строения
—твёрдые при обычных условиях;
—хрупкие;
—тугоплавкие;
—нелетучие;
—растворы и расплавы проводят электрический ток.
ионного строения
—твёрдые при обычных условиях;
—хрупкие;
—тугоплавкие;
—нелетучие;
—не растворимы в воде, не проводят электрический ток.
Используя данную информацию, определите, какое строение имеют вещества: алмаз С и гидроксид калия КОН. Запишите ответ в отведённом месте.
1. Алмаз С
2. Гидроксид калия КОН
Оксиды условно подразделяют на четыре группы, как показано на схеме. В эту схему для каждой из четырёх групп впишите пропущенные названия групп или химические формулы оксидов (по одному примеру формул), принадлежащих к данной группе.
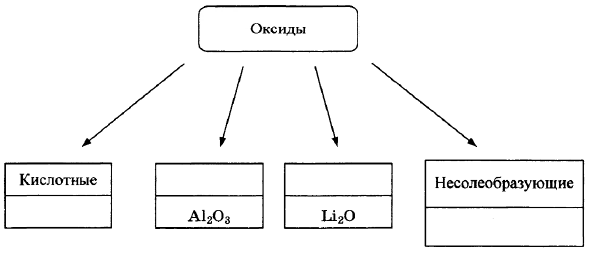
Элементы ответа:
Записаны названия групп: амфотерные, основные; записаны Формулы веществ соответствующих групп.
(Допускаются иные формулировки ответа, не искажающие его смысла.)
Карбонат натрия (кальцинированная сода, Na2CO3) используют в стекольном производстве, мыловарении и производстве стиральных и чистящих порошков, эмалей, для получения красителя ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще для уменьшения жёсткости воды. В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки Е500 — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию.
Карбонат натрия можно получить взаимодействием щёлочи и углекислого газа. В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день. В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода. Выпавший остаток малорастворимого гидрокарбоната натрия отфильтровывают и кальцинируют (прокаливают) нагреванием до 140—160 °С, при этом он переходит в карбонат натрия.
Римский врач Диоскорид Педаний писал о соде как о веществе, которое шипело с выделением газа при действии на него известных к тому времени кислот — уксусной СН3СООН и серной H2SO4.
1) Запишите оговорённое в тексте молекулярное уравнение реакции получения карбоната натрия взаимодействием щелочи и углекислого газа.
2) Что представляет собой мыло с химической точки зрения?
1) 2NaOH + CO2 = Na2CO3 + H2O
2) Мыло с химической точки зрения представляет собой натриевую или калиевую соль одной из высших карбоновых кислот (пальмитиновой, стеариновой...)
1) Запишите в молекулярном виде оговорённое в тексте уравнение разложения гидрокарбоната натрия, приводящего к образованию кальцинированной соды.
2) Что такое «жёсткость воды»?
1) Са(ОН)2 + СO2 = СаСO3↓ + Н2O
2) Признак реакции — образование белого осадка карбоната кальция
1) Запишите в сокращённом ионном виде оговорённое в тексте уравнение взаимодействия соды с уксусной кислотой.
2) К каким электролитам — сильным или слабым — относится карбонат натрия?
1) Са(ОН)2 + FeSO4 = Fe(OH)2↓ + CaSO4↓
2) В результате реакции гидроксид железа выпадает в осадок и содержание железа в воде существенно уменьшается
Дана схема окислительно-восстановительной реакции:
HIO3 + Н2O2 → I2 + O2 + Н2O
1) Составьте электронный баланс для этой реакции.
2) Укажите окислитель и восстановитель.
3) Расставьте коэффициенты в уравнении реакции.
1) Составлен электронный баланс:

2) Указано, что окислителем является I+5 (или йодноватая кислота), восстановителем — О-1 (или пероксид водорода);
3) Составлено уравнение реакции:
2НIO3 + 5Н2O2 = I2 + 5O2 + 6Н2O
Дана схема превращений:
Р → Р2O5 → Са3(РO4)2 → Са(Н2РO4)2
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
1) 4Р + 5O2 = 2Р2O5
2) Р2O5 + ЗСаО = Са3(РO4)2
3) Са3(РО4)2 + 4Н3РO4 = ЗСа(Н2РO4)2
Установите соответствие между классом органических веществ и формулой его представителя: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
КЛАСС ВЕЩЕСТВ
А) 1,2-диметил бензол
Б) 2-метилбутен-2
В) ацетилен
ФОРМУЛА ПРЕДСТАВИТЕЛЯ
1) алканы
2) алкины
3) алкены
4) арены
В предложенные схемы химических реакций вставьте формулы пропущенных веществ и расставьте коэффициенты.
1) СН3СООН + ______ → (СН3СОО)2Ва+ Н2O
2) С7Н8 + O2 → _____ + Н2O
1) 2СН3СООН + Ва(ОН)2 → (СН3СОО)2Ва + 2Н2O
2) С7Н8 + 9O2 → 7СO2 + 4Н2O
Бутан сгорает с низким уровнем выброса токсичных веществ в атмосферу, поэтому его используют в качестве источника энергии во многих областях, например в смеси с пропаном — в газовых зажигалках и при отоплении загородных домов.
Какой объём углекислого газа (н.у.) образуется при полном сгорании 5,8 г бутана? Запишите подробное решение задачи.
1) Составлено уравнение горения бутана:
2С4Н10 + 13O2 → 8СO2 + 10Н2O
2) n(С4Н10) = m/М = 5,8 г / 58 г/моль = 0,1 моль
n(C02) = 4n(С4Н10) = 0,4 моль
3) V(C02) = п • Vm = 0,4 моль • 22,4 л/моль = 8,96 л
Метанол — простейший одноатомный спирт. Его используют для синтеза большого числа органических веществ, включая формальдегид, уксусную кислоту, различные растворители и пластмассы. По приведенной ниже схеме составьте уравнения реакций, характеризующих химические свойства метанола. В уравнениях используйте структурные формулы органических веществ.
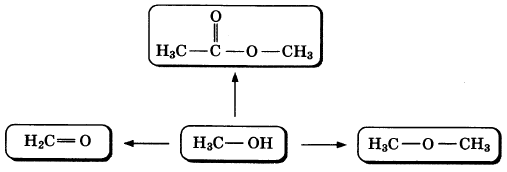
1)
2)
3)
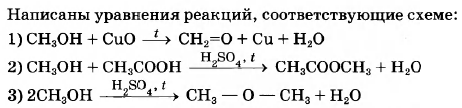
Физиологическим раствором в медицине называют 0,9%-ный раствор хлорида натрия в воде. Рассчитайте массу (г) хлорида натрия и массу (г) воды, которые необходимы для приготовления 1 кг физиологического раствора. Запишите подробное решение задачи.
Элементы ответа: 1) m(NaCl) = m(p-pa) • w = 1000 г • 0,009 = 9 г 2) m(H2O) = 1000 г - 9 г = 991 г