Вариант 7
Проверочная работа включает в себя 15 заданий. На выполнение работы по химии отводится 1 час 30 минут (90 минут).
Из курса химии вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация.
На рисунках 1—3 представлены ситуации, в которых применены некоторые из перечисленных способов.
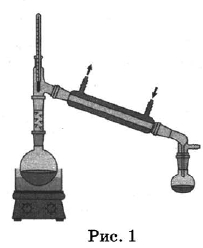
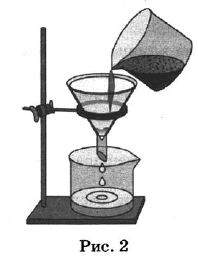
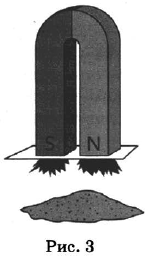
Какими из способов, которые показаны на рисунках, МОЖНО разделить смеси:
1) ацетата натрия и бензола;
2) пентана и толуола;
3) железных стружек и поваренной соли?
| Смесь | Номера рисунков, соответствующие способам разделения смесей, которые МОЖНО использовать |
| Ацетат натрия и бензол | |
| Пентан и толуол | |
| Железные стружки и поваренная соль |
| Смесь | Номера рисунков, соответствующие способам разделения смесей, которые МОЖНО использовать |
| Ацетат натрия и бензол | 1,2 |
| Пентан и толуол | 1 |
| Железные стружки и поваренная соль | 2,3 |
На рисунке изображена модель электронного строения атома некоторого химического элемента.
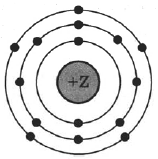
На основании анализа предложенной модели:.
1) Определите заряд ядра Z.
2) Укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент..
3) Определите валентность элемента в его соединении с водородом.
| Символ химического элемента | № периода | № группы | Валентность в соединении с водородом |
Периодическая система химических элементов Д.И. Менделеева богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что кислотный характер высших оксидов элементов в периодах с увеличением заряда ядра усиливается, а в группах — уменьшается.
Учитывая эти закономерности, расположите в порядке усиления кислотных свойств высших оксидов следующие элементы: В, С, N, Аl. Запишите обозначения элементов в нужной последовательности.
В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют молекулярное и ионное строение.
Молекулярного строения
— при обычных условиях имеют жидкое, газообразное или твёрдое агрегатное состояние;
— имеют низкие значения температур кипения и плавления;
— имеют низкую теплопроводность.
Ионного строения
— твёрдые при обычных условиях;
— хрупкие;
— тугоплавкие;
— нелетучие;
— в расплавах и растворах проводят электрический ток.
Используя данную информацию, определите, какое строение имеют вещества: бром Вr2 и негашеная известь СаО.
1) Бром Вr2 _____
2) Негашеная известь СаО ____
Оксиды условно подразделяют на четыре группы, как показано на схеме. В эту схему для каждой из четырёх групп впишите пропущенные названия групп или химические формулы оксидов (по одному примеру формул), принадлежащих к данной группе.
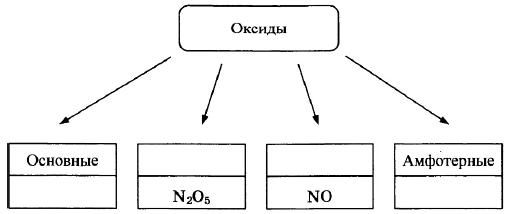
Элементы ответа:
Записаны названия групп: кислотные, несолеобразующие (безразличные); записаны формулы веществ соответствующих групп.
(Допускаются иные формулировки ответа, не искажающие его смысла.)
Гидроксид кальция Са(ОН)2 относится к наиболее используемым в быту и промышленности неорганическим соединениям. Получение гидроксида кальция в промышленном масштабе возможно путём смешивания оксида кальция с водой, этот процесс называется гашением.
Широкое применение гидроксид кальция получил в производстве таких строительных материалов, как белила, штукатурка и гипсовые растворы. Это связано с его способностью взаимодействовать с углекислым газом СO2, содержащимся в воздухе. Это же свойство раствора гидроксида кальция применяется для измерения количественного содержания углекислого газа в воздухе.
Полезным свойством гидроксида кальция является его способность выступать в роли флокулянта, очищающего сточные воды от взвешенных и коллоидных частиц (в том числе солей железа).
1) Составьте молекулярное уравнение реакции «гашения» оксида кальция, которая упоминалась в тексте.
2) Укажите, к каким реакциям — эндотермическим или экзотермическим — относится гашение оксида кальция.
Элементы ответа:
1) СаО + Н2О = Са(ОН)2
2) Экзотермическая реакция
1) Составьте молекулярное уравнение реакции между гидроксидом кальция и углекислым газом, о которой говорилось в тексте.
2) Укажите признаки этой реакции.
Элементы ответа:
1) Са(ОН)2 + СО2 = СаСО3↓ + Н2О
2) Признак реакции — образование белого осадка карбоната кальция
1) Составьте сокращённое ионное уравнение реакции между гидроксидом кальция и сульфатом железа(II), о которой говорилось в тексте.
2) Объясните, почему эту реакцию используют для очистки воды.
Элементы ответа:
1) Са(ОН)2 + FeSO4 = Fe(OH)2↓ + CaSО4↓
2) В результате реакции гидроксид железа выпадает в осадок и содержание железа в воде существенно уменьшается
Дана схема окислительно-восстановительной реакции:
Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O
1) Составьте электронный баланс для этой реакции.
2) Укажите окислитель и восстановитель.
3) Расставьте коэффициенты в уравнении реакции.
1) Составлен электронный баланс:

2) Указано, что окислителем является N+5 (или азотная кислота), восстановителем — цинк Zn;
3) Составлено уравнение реакции:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2OДана схема превращений:
Сu → Cu(NO3)2 → СuО → CuSO4
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
1) 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4Н2O
2) 2Cu(NO3)2 = 2СuО + 4NO2↑ + O2↑
3) СuО + H2SO4 = CuSO4 + H2O
Установите соответствие между формулой органического вещества и формулой его изомера: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) этаналь
Б) бутанон
В) пентанол-1
ФОРМУЛА ИЗОМЕРА
1) простые эфиры
2) спирты
3) кетоны
4) альдегиды
В предложенные схемы химических реакций вставьте формулы пропущенных веществ и расставьте коэффициенты.
1) С2Н6+ _____ → С2Н5Вr+ НВr
2) С2Н2 + _____ → СO2 + Н2O
Элементы ответа:
1) С2Н6 + Вг2 = С2Н5Вr+ НВr
2) 2С2Н2 + 502 = 4СO2 + 2Н2O
Уксусная кислота является ведущим продуктом основного органического синтеза и применяется для получения красителей, лекарственных и душистых веществ. В частности, к душистым веществам относятся сложные эфиры уксусной кислоты.
Какая масса этилацетата теоретически может быть получена исходя из 120 г уксусной кислоты? Запишите подробное решение задачи.
1) Составлено уравнение синтеза этилацетата:
СН3СООН + С2Н5ОН → СН3СООС2Н5 + Н2O
2) n(кислоты) = m/М =120 г/60 г/моль = 2 моль
n(эфира) = n(кислоты) = 2 моль
3) m(эфира) = n • М = 2 моль • 88 г/моль = 176 г
Бензол широко используется в производстве красителей, лекарств, взрывчатых веществ, а также в качестве эффективного растворителя. В соответствии с приведённой ниже схемой составьте уравнения реакций получения бензола. При написании уравнений реакций используйте структурные формулы органических веществ.
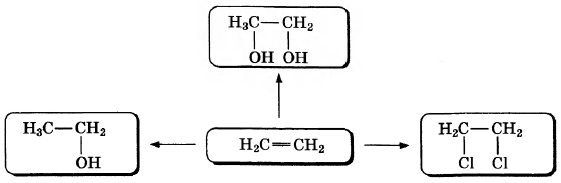
1)
2)
3)
В медицине широко используется раствор сульфата магния под названием «магнезия». Рассчитайте массу воды, необходимую для растворения 100 г магнезии (MgSO4 • 7Н2O) с целью получения 25%-ного раствора сульфата магния. Запишите подробное решение задачи.
1) n(MgSO4) = n(MgSO4 • 7Н2O) = m/М = 100 г/246 г/моль = 0,41 моль
m(MgSO4) = n(MgSO4) • М = 0,41 моль • 120 г/моль = 49,2 г
m(p-pa) = m(MgSO4)/ω = 49,2 г/0,25 = 196,8 г
2) m(Н2O) = m(p-pa) - m(MgSO4 • 7Н2O) = 196,8 г - 100 г = 96,8 г