Вариант 6
Проверочная работа включает в себя 15 заданий. На выполнение работы по химии отводится 1 час 30 минут (90 минут).
Из курса химии вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация.
На рисунках 1—3 представлены ситуации, в которых применены некоторые из перечисленных способов.

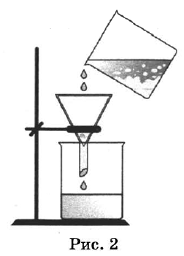
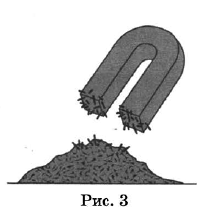
Какими из способов, которые показаны на рисунках, НЕЛЬЗЯ разделить смесь:
1) иодида свинца и воды;
2) сульфата натрия и сульфата бария;
3) железных и древесных стружек?
| Смесь | Номера рисунков, соответствующие способам разделения смесей, которые НЕЛЬЗЯ использовать |
| Иодид свинца и вода | |
| Сульфат натрия и сульфат бария | |
| Железные и древесные стружки |
| Смесь | Номера рисунков, соответствующие способам разделения смесей, которые НЕЛЬЗЯ использовать |
| Иодид свинца и вода | 3 |
| Сульфат натрия и сульфат бария | 1,3 |
| Железные и древесные стружки | 1,2 |
На рисунке изображена модель электронного строения атома некоторого химического элемента.
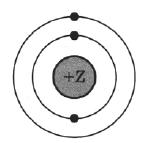
На основании анализа предложенной модели выполните следующие задания:
1) Определите химический элемент, атом которого имеет такое электронное строение.
2) Укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент.
3) Определите возможную высшую степень окисления элемента в соединениях.
| Символ химического элемента | № периода | № группы | Высшая степень окисления |
Периодическая система химических элементов Д.И. Менделеева — богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что кислотный характер высших оксидов элементов в периодах с увеличением заряда ядра усиливается, а в группах — уменьшается.
Учитывая эти закономерности, расположите в порядке ослабления кислотных свойств высших оксидов следующие элементы: Р, As, S, Cl. Запишите обозначения элементов в нужной последовательности.
Ниже перечислены характерные свойства веществ, которые имеют молекулярное и атомное строение.
молекулярного строения
—при обычных условиях имеют жидкое, газообразное или твёрдое агрегатное состояние;
—имеют низкие значения температур кипения и плавления;
—имеют низкую теплопроводность.
ионного строения
—твёрдые при обычных условиях;
—хрупкие;
—тугоплавкие;
—нелетучие;
—в расплавах и растворах проводят электрический ток.
Используя данную информацию, определите, какое строение имеют вещества: иод и красный фосфор. Запишите ответ в отведённом месте.
1. Иод
2. Красный фосфор
Оксиды условно подразделяют на четыре группы, как показано на схеме. В эту схему для каждой из четырёх групп впишите пропущенные названия групп или химические формулы оксидов (по одному примеру формул), принадлежащих к данной группе.
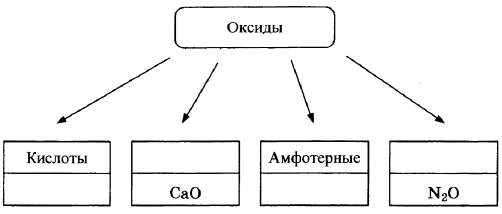
Элементы ответа:
Записаны названия групп: основные, несолеобразующие (безразличные); записаны формулы веществ соответствующих групп.
(Допускаются иные формулировки ответа, не искажающие его смысла.)
Серная кислота (H2SO4) является одним из основных продуктов крупнотоннажной химии. Без неё невозможно производство удобрений, полимеров, лекарств, красителей. Ежегодно во всём мире производят примерно 220 млн тонн серной кислоты.
Разбавленная серная кислота обладает всеми общими свойствами кислот, реагирует с основаниями, основными и амфотерными оксидами, гидроксидами металлов, металлами и солями. Концентрированная серная кислота является сильным дегидратирующим средством. При растворении серную кислоту тонкой струйкой приливают к воде, но не наоборот! H2SO4 проявляет довольно сильные окислительные свойства и способна окислять неметаллы и некоторые малоактивные металлы, стоящие в ряду стандартных окислительно-восстановительных потенциалов («ряд напряжений металлов») после водорода. Как правило, при действии металлов водород из концентрированной серной кислоты не выделяется.
В одном из способов получения серной кислоты первой стадией является обжиг пирита FeS2 в присутствии кислорода воздуха. Обжиг «в кипящем слое» ведут в печах специальной конструкции. Образовавшийся сернистый газ тщательно очищают и окисляют до оксида серы(VI), который поглощают концентрированной серной кислотой. Продукт поглощения после разбавления водой превращается в серную кислоту нужной концентрации.
1) Напишите уравнение реакции окисления серы концентрированной серной кислотой.
2) Объясните, почему при растворении серную кислоту всегда приливают к воде, но не наоборот.

2) Растворение серной кислоты в воде сопровождается сильным разогревом смеси, которое объясняется образованием прочных гидратов серной кислоты (выделяется энергия гидратации). В сосуд для приготовления электролита сначала заливается вода, а затем при непрерывном помешивании серная кислота. Вливать воду в концентрированную серную кислоту запрещается, так как в этом случае происходит быстрое разогревание воды, она вскипает и разбрызгивается вместе с кислотой. Происходит это из-за различий в теплоёмкости и плотности воды и кислоты.
1) Напишите уравнение взаимодействия серной кислоты с гидроксидом железа(III).
2) Приведите формулы возможных продуктов восстановления концентрированной серной кислоты.
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6Н2O
SO2, S и H2S
1) Запишите в кратком ионном виде уравнение реакции между раствором серной кислоты и нитратом бария.
2) Укажите, что является признаком протекающей при этом реакции.
Ва2+ + SO42- = BaSO4↓
Признак протекающей при этом реакции — образование белого осадка
Дана схема окислительно-восстановительной реакции:
Сl2 + K2S + КОН → КСl + K2SO4 + Н2O
1) Составьте электронный баланс для этой реакции.
2) Укажите окислитель и восстановитель.
3) Расставьте коэффициенты в уравнении реакции.
1) Составлен электронный баланс:

2) Указано, что окислителем является хлор Сl2, восстановителем — S-2 (или сульфид калия);
3) Составлено уравнение реакции: 4Сl2 + K2S + 8КОН → 8КСl + K2SO4 + 4Н2O
Дана схема превращений:
Zn → ZnCl2 → Zn(NO3)2 → ZnO
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
1) Zn + 2НСl = ZnCl2 + H2↑
2) ZnCl2 + 2AgNO3 = Zn(NO3)2 + 2AgCl↓
3) 2Zn(NO3)2 = 2ZnO + 4NO2↑ + O2↑
Установите соответствие между названием органического вещества и общей формулой класса, к которому это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) бензол
Б) 2-метилбутан
В) ацетилен
Общая формула
1) СnH2n+2
2) CnH2n
3) CnH2n-2
4) CnH2n-6
В предложенные схемы химических реакций вставьте формулы пропущенных веществ и расставьте коэффициенты.
1) _____ + Na2CO3 →CH3COONa + H2O + CO2 ↑
2) С4Н6 + ______ → СO2+ Н20
1) 2СН3СООН + Na2CO3 → 2CH3COONa + Н2O + СO2↑
2) 2С4Н6 + 11O2 → 8СO2 + 6Н2O
Уксусная кислота — один из основных продуктов многотоннажной химии, широко применяется для получения красителей, лекарственных и душистых веществ. В частности, к душистым веществам относятся сложные эфиры уксусной кислоты.
Какая масса уксусной кислоты необходима для синтеза 8,8 г этилового эфира уксусной кислоты? Запишите подробное решение задачи.
1) Составлено уравнение синтеза этилацетата:
СН3СООН + С2Н5ОН → СН3СООС2Н5 + Н2O
2) n(эфира) = m/М = 8,8 г / 88 г/моль = 0,1 моль
n(кислоты) = n(эфира) = 0,1 моль
3) m(кислоты) = n • М = 0,1 моль • 60 г = 6 г
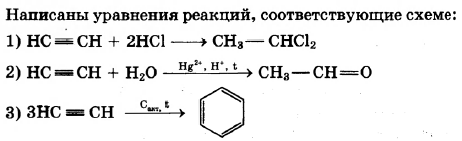
Ацетилен — простейший углеводород с тройной связью. Его используют для газовой сварки, а также для получения уксусной кислоты, этилового спирта, растворителей и пластмасс. По приведённой ниже схеме составьте уравнения реакций, характеризующих химические свойства ацетилена. В уравнениях используйте структурные формулы органических веществ.
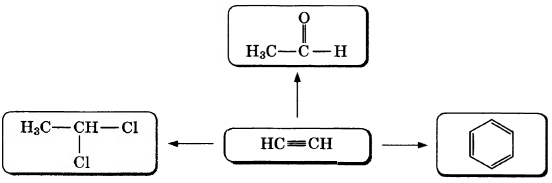
1)
2)
3)
Электролитом для зарядки автомобильных аккумуляторов служит 37%-ный раствор серной кислоты. Рассчитайте массу серной кислоты и массу воды, которые содержатся в 1 л электролита, плотность которого равна 1,28 г/мл. Запиши те подробное решение задачи.
Элементы ответа:
1 ) m(электролита) = V*р = 1000 мл • 1,28 г/мл = 1280 г
m(H2SO4) = m(электролита) • ω = 1280 г • 0,37 = 473,6 г
2) m(Н2O) = 1280 г - 473,6 г = 806,4 г