Вариант 5
Проверочная работа включает в себя 15 заданий. На выполнение работы по химии отводится 1 час 30 минут (90 минут).
Из курса химии вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация.
На рисунках 1—3 представлены ситуации, в которых применены некоторые из перечисленных способов.
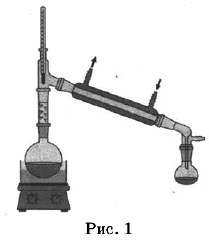
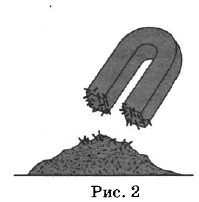
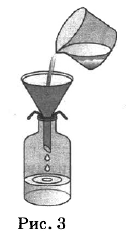
Какими из способов, которые показаны на рисунках, НЕЛЬЗЯ разделить смеси:
1) сплав железа и золота;
2) поваренной соли и порошка оконного стекла;
3) пропионовой кислоты и ацетона?
| Смесь | Номера рисунков, соответствующие способам разделения смесей, которые НЕЛЬЗЯ использовать |
| Сплав железа и золота | |
| Поваренная соль и порошок оконного стекла | |
| Пропионовая кислота и ацетон |
| Смесь | Номера рисунков, соответствующие способам разделения смесей, которые НЕЛЬЗЯ использовать |
| Сплав железа и золота | 1,2,3 |
| Поваренная соль и порошок оконного стекла | 1,2 |
| Пропионовая кислота и ацетон | 2,3 |
На рисунке в упрощенном виде представлена электронная конфигурация атома некоторого химического элемента.
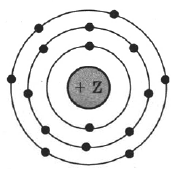
На основании анализа предложенной модели:
1) Определите химический элемент, атом которого имеет такое электронное строение.
2) Укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент.
3) Определите низшую возможную степень окисления элемента.
| Символ химического элемента | № периода | № группы | Металл/неметалл |
Периодическая система химических элементов Д.И. Менделеева богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что с увеличением порядкового номера химического элемента в периодах радиусы атомов уменьшаются, а в группах — увеличиваются.
Учитывая эти закономерности, расположите в порядке увеличения радиуса атомов следующие элементы: N, О, Si, Р. Запишите обозначения элементов в нужной последовательности.
Ниже перечислены характерные свойства веществ, которые имеют молекулярное и атомное строение.
молекулярного строения
—твёрдые при обычных условиях;
—хрупкие;
—тугоплавкие;
—нелетучие;
—растворы и расплавы проводят электрический ток.
ионного строения
—твёрдые при обычных условиях;
—хрупкие;
—тугоплавкие;
—нелетучие;
—не растворимы в воде, не проводят электрический ток.
Используя данную информацию, определите, какое строение имеют вещества кварц SiO2 и хлорид кальция СаСl2. Запишите ответ в отведённом месте
1. Кварц SiO2
2. Хлорид кальция СаСl2
В классификации сложных неорганических веществ можно выделить четыре класса, как показано на схеме. В эту схему для каждого из четырёх классов впишите пропущенные названия классов или химические формулы веществ (по одному примеру формул), принадлежащих к данному классу.
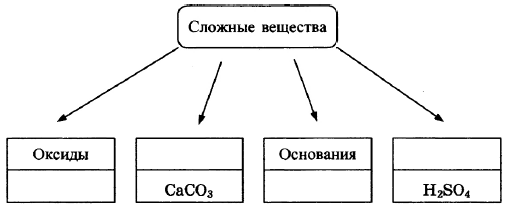
Элементы ответа:
Записаны названия классов: соли, кислоты; записаны формулы веществ соответствующих групп.
(Допускаются иные формулировки ответа, не искажающие его смысла.)
Аммиак (NH3) — одно из наиболее используемых в промышленности неорганических веществ.
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония. Внимание! При получении аммиака держите пробирку-приёмник дном кверху. Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота.
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных электрона атома азота участвуют в образовании ковалентных связей с 1s-электронами трёх атомов водорода (связи N—Н), четвёртая пара внешних электронов является неподелённой. При нормальных условиях аммиак — бесцветный газ с резким характерным запахом (запах нашатырного спирта), хорошо растворим в воде, ядовит. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах.
Для аммиака характерны реакции как с изменением степени окисления атома азота (реакции окисления), так и без изменения степени окисления атома азота (реакции присоединения).
1) Составьте молекулярное уравнение оговорённой в тексте реакции получения аммиака действием любой щёлочи на хлорид аммония.
2) Укажите, почему при получении аммиака пробирку-приёмник следует дер жать дном кверху.
Элементы ответа:

2) Аммиак — газ легче воздуха, поэтому пробирку для его собирания держат дном вверх
1) Составьте молекулярное уравнение оговорённой в тексте реакции окисления аммиака кислородом.
2) Укажите, к каким процессам — эндотермическим или экзотермическим — относится эта реакция.
Элементы ответа:
1) 4NH3 + 3О2 = 2N2 + 6Н2О
2) Реакция экзотермическая
1) Составьте сокращённое ионное уравнение реакции, записанной вами при ответе на вопрос 6.
2) Объясните, какая реакция среды (кислая, нейтральная или щелочная) характерна для водного раствора аммиака.
Элементы ответа:
1) NH4+ + ОН- = Н2О + NH3
2) Реакция среды водного раствора аммиака — щелочная, что связано с протеканием реакции: NH3 + Н2О ⇄ NH4+ + ОН-
Дана схема окислительно-восстановительной реакции:
Н2S + FeCl3 → FeCl2 + S + НС1
1) Составьте электронный баланс для этой реакции.
2) Укажите окислитель и восстановитель.
3) Расставьте коэффициенты в уравнении реакции.
1) Составлен электронный баланс:

2) Указано, что окислителем является Fe+3 (или трихлорид железа), восстановителем — S-2 (или сероводород);
3) Составлено уравнение реакции:
H2S + 2FeCl3 = 2FeCl2 + S + 2HCl
Дана схема превращений:
Zn → ZnSO4 → Zn(NO3)2 → ZnO
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
1) Zn + H2SO4 = ZnSO4 + H2↑
2) ZnSO4 + Ba(NO3)2 = Zn(NO3)2 + BaSO4↓
3) 2Zn(NO3)2 = 2ZnO + 4NO2↑ + O2↑
Установите соответствие между формулой органического вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) СН3СН=СН2
Б) СН3(СН2)4СН3
В) CH3CH2NH2
КЛАСС / ГРУППА
1) предельные углеводороды
2) непредельные углеводороды
3) амины
4) аминокислоты
В предложенные схемы химических реакций вставьте формулы пропущенных веществ и расставьте коэффициенты.
1) СН3СООН + _____ → (СН3СОО)2Са + Н2O + СO2 ↑
2) С4Н10 + _____ → СO2 + Н2O
1) 2СН3СООН + СаСO3 → (СН3СОО)2Са + Н2O + CO2↑
2) 2С4Н10 + 13O2 → 8СO2 + 10Н2О
Этилен является ведущим продуктом основного органического синтеза и применяется для получения дихлорэтана, этилового спирта, стирола, уксусной кислоты и полиэтилена. Наиболее перспективным методом получения этого вещества является каталитическое разложение метана на этилен и водород.
Какой объем (н.у.) этилена образуется в ходе каталитического разложения 1,6 кг метана? Запишите подробное решение задачи.
1) Составлено уравнение каталитического разложения метана:

2) n(СН4) = m/М = 1600 г/16 г/моль = 100 моль
n(С2Н4) = ½ • n(СН4) = 50 моль
3) V(C2H4) = VM • n = 22,4 л/моль • 50 моль = 1120 л
Фенол — простейшее кислородсодержащее производное бензола. В больших количествах его применяют для синтеза поликарбонатов, эпоксидных смол, искусственных волокон, лекарственных препаратов и средств для дезинфекции. По приведённой ниже схеме составьте уравнения реакций, характеризующих химические свойства фенола. В уравнениях используйте структурные формулы органических веществ.
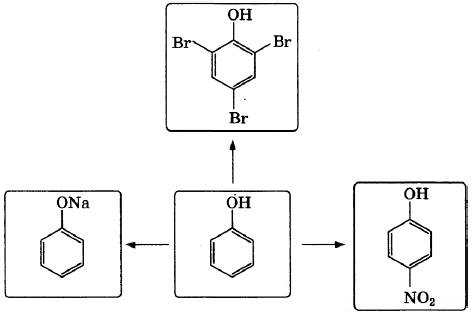
1)
2)
3)
В сельском хозяйстве для борьбы с грибковыми заболеваниями растений используют 5%-ный раствор сульфата железа(II). Рассчитайте массу железного купороса (FeSO4 • 7Н2O), который следует взять для получения 1000 г 5% -ного раствора сульфата железа(II). Запишите подробное решение задачи.
1) m(FeSO4) = m(p-pa)•ω = 1000 • 0,05 = 50 г
n(FeSO4 • 7Н2O) = n(FeSO4) = т/М = 50 г/152 г/моль = 0,33 моль
2) m(FeSO4 • 7Н2O) = n(FeSO4 • 7Н2O) • М = 0,33 моль • 278 г/моль = 91,7 г