Вариант 3
Проверочная работа включает в себя 15 заданий. На выполнение работы по химии отводится 1 час 30 минут (90 минут).
Из курса химии вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация.
На рисунках 1—3 представлены ситуации, в которых применены некоторые из перечисленных способов.
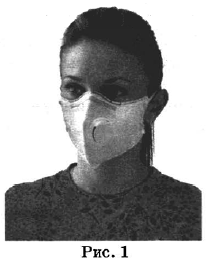
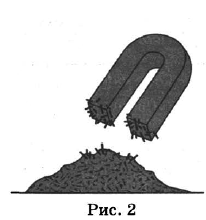

Каким из способов, которые показаны на рисунках, можно разделить смеси, чтобы отделить:
1) воздух от содержащихся в нём частиц смога;
2) железные опилки от медных?
Назовите способ, который был применён в каждом из приведённых выше примеров.
| Cмесь | Номер рисунка | Способ разделения смеси |
| Воздух и частицы смога | ||
| Железные и медные опилки |
| Cмесь | Номер рисунка | Способ разделения смеси |
| Воздух и частицы смога | 1 | Фильтрование |
| Железные и медные опилки | 2 | Действие магнитом |
На рисунке изображена модель электронного строения атома некоторого химического элемента.
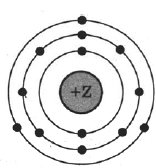
На основании анализа предложенной модели:
1) Определите химический элемент, атом которого имеет такое электронное строение.
2) Укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент.
3) Определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
| Символ химического элемента | № периода | № группы | Металл/неметалл |
Периодическая система химических элементов Д.И. Менделеева — богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что с увеличением порядкового номера химического элемента в периодах радиусы атомов уменьшаются, а в группах — увеличиваются.
Учитывая эти закономерности, расположите в порядке увеличения радиуса атомов следующие элементы: В, Al, Ga, Be. Запишите знаки элементов в нужной последовательности .
Ниже перечислены характерные свойства веществ, которые имеют молекулярное и ионное строение.
молекулярного строения
—при обычных условиях имеют жидкое, газообразное или твёрдое агрегатное состояние;
—имеют низкие значения температур кипения и плавления;
—имеют низкую теплопроводность.
ионного строения
—твёрдые при обычных условиях;
—хрупкие;
—тугоплавкие;
—нелетучие;
—в расплавах и растворах проводят электрический ток.
Используя данную информацию, определите, какое строение имеют вещества: азотная кислота HNO3 и сульфат натрия Na2SO4. Запишите ответ в отведённом месте:
1. Азотная кислота HNO3
2. Сульфат натрия Na2SO4
В классификации сложных неорганических веществ можно выделить четыре класса, как показано на схеме. В эту схему для каждого из четырёх классов впишите пропущенные названия классов или химические формулы веществ (по одному примеру формул), принадлежащих к данному классу.
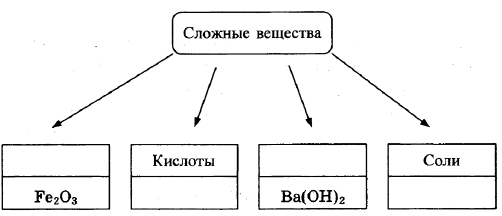
Элементы ответа:
Записаны названия классов: оксиды, основания; записаны формулы веществ соответствующих групп.
(Допускаются иные формулировки ответа, не искажающие его смысла.)
Карбонат натрия (кальцинированная сода, Na2CO3) используют в стекольном производстве, мыловарении и производстве стиральных и чистящих порошков, эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще для уменьшения жёсткости воды. В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки Е500 — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию.
Теоретически карбонат натрия можно получить взаимодействием соответствующих оксидов — кислотного и основного. В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день. В насыщенный раствор хлорида натрия пропускают одинаковые количества газообразных аммиака и диоксида углерода. Выпавший остаток малорастворимого гидрокарбоната натрия отфильтровывают и кальцинируют (прокаливают) нагреванием до 140—160°С, при этом он переходит в карбонат натрия.
Римский врач Диоскорид Педаний писал о соде как о веществе, которое шипело с выделением газа при действии на него известных к тому времени кислот — уксусной СН3СООН и серной H2SO4.
1) Запишите оговорённое в тексте молекулярное уравнение реакции получения карбоната натрия взаимодействием двух оксидов.
2) Взаимодействием каких трёх веществ получают обычное оконное стекло? Приведите формулы этих веществ или формулу оконного стекла.
1) Na2O + СO2 = Na2CO3
2) Стекло получают взаимодействием речного песка SiO2, известняка СаСO3 и соды Na2CO3. Или: формула стекла Na2O • СаО • 6SiO2
1) Запишите в молекулярном виде оговорённое в тексте уравнение реакции образования гидрокарбоната натрия, которая происходит при пропускании аммиака и углекислого газа через раствор поваренной соли.
2) Какая реакция среды в растворе карбоната натрия?
1) NaCl + NH3 + СO2 + Н2O = NaHCO3 + NH4Cl
2) В растворе карбоната натрия — щелочная среда за счёт гидролиза соли, образованной сильным основанием и слабой кислотой.
1) Запишите в сокращённом ионном виде уравнение взаимодействия соды с серной кислотой.
2) Укажите, какая кислота сильнее — серная или уксусная?
1) СO32- + 2Н+ = H2O + CO2↑
2) Более сильная — серная кислота
Дана схема окислительно-восстановительной реакции:
NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + Н2O
1) Составьте электронный баланс для этой реакции.
2) Укажите окислитель и восстановитель.
3) Расставьте коэффициенты в уравнении реакции.
1) Составлен электронный баланс:

2) Указано, что окислителем является бром Вг2, восстановителем — Сг+3 (или хромит натрия);
3) Составлено уравнение реакции:
2NaCrO2 + 3Br2 + 8NaOH = 2Na2CrO4 + 6NaBr + 4Н2O
Дана схема превращений:
Сu → СuСl2 → Cu(NO3)2 → Сu(ОН)2
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
1) Сu + Сl2 = СuСl2
2) СuСl2 + 2AgNO3 = Cu(NO3)2 + 2AgCl↓
3) Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Установите соответствие между формулой органического вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) СН3СН2СООН
Б) СН3 — СО — СН3
В) CH3CH2CH=O
КЛАСС / ГРУППА
1) альдегиды
2) кетоны
3) сложные эфиры
4) карбоновые кислоты
В предложенные схемы химических реакций вставьте формулы пропущенных веществ и расставьте коэффициенты.
1) С2Н5ОН + ____ → С2Н5Вr+ Н2O
2) С4Н8 + O2 → СO2 + ____
1) С2Н5ОН + HBr → С2Н5Вr+ Н2O
2) С4Н8 + 6O2 → 4СO2 + 4H2O
Реакции крекинга (расщепления молекул углеводородов на два примерно одинаковых фрагмента) лежат в основе вторичной переработки нефти, цель которой — превращение тяжелых нефтяных фракций в бензин.
Какая масса пентена образуется в ходе крекинга 71 г декана? Запишите подробное решение задачи.
1) Составлено уравнение крекинга декана:

2) n(C10H 22) = m/М = 71 г /142 г/моль = 0,5 моль
n(С5Н10) = n(С10Н22) = 0,5 моль.
3) m(С5Н10) = 0,5 моль • 70 г/моль = 35 г.
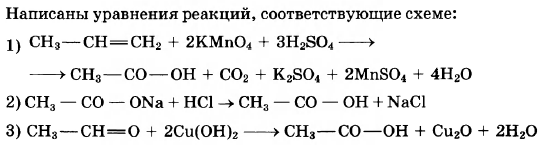
Уксусная кислота широко используется в пищевой промышленности в качестве приправы и консерванта. В соответствии с приведённой ниже схемой составьте уравнения реакций получения этой кислоты. При написании уравнений реакций используйте структурные формулы органических веществ.
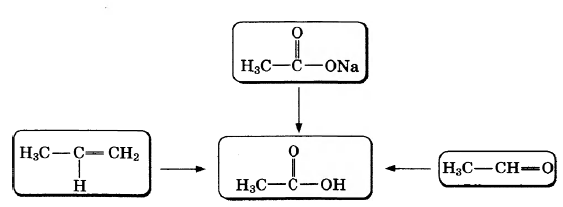
1)
2)
3)
В медицине для антисептической обработки ран используется 3%-ный раствор пероксида водорода. Рассчитайте массу воды и массу концентрированного 30%-ного раствора пероксида водорода, необходимые для получения 200 г 3%-ного раствора Н2O2. Запишите подробное решение задачи.
Элементы ответа:
1) m(Н2O2)конечн. = ω2 • m(р-ра) = 0,03 • 200 г = 6 г
m исх. р-ра(Н2O2) = m(Н2O2)конечн. / ω1 = 6 г/0,30 = 20 г
2) m(Н2O) = 200 г - 20 г = 180 г