Вариант 2
Проверочная работа включает в себя 15 заданий. На выполнение работы по химии отводится 1 час 30 минут (90 минут).
Из курса химии вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация.
На рисунках 1-3 представлены ситуации, в которых применены некоторые из перечисленных способов.
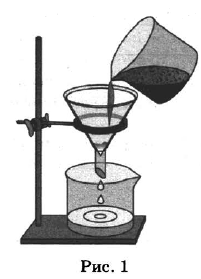
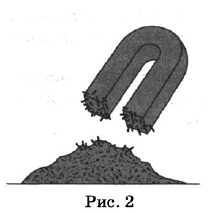
Какие из названных способов разделения смесей можно применить для очищения:
1) крахмала от попавших в него железных опилок;
2) взвесь глины в воде?
Назовите способ, который был применён в каждом из приведённых выше примеров. Ответы впишите в следующую таблицу:
| Смесь | Номер рисунка | Способ разделения смеси |
| Крахмал и попавшие в него железные опилки | ||
| Взвесь глины в воде |
| Смесь | Номер рисунка | Способ разделения смеси |
| Крахмал и попавшие в него железные опилки | 2 | Действие магнитом |
| Взвесь глины в воде | 1 | Фильтрование |
На рисунке изображена модель электронного строения атома некоторого химического элемента.
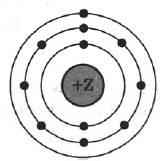
На основании анализа электронной конфигурации выполните следующие задания:
1) Определите заряд ядра Z.
2) Укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент.
3) Определите валентность элемента в его высшем оксиде.
| Заряд ядра | № периода | № группы | Валентность в высшем оксиде |
Периодическая система химических элементов Д.И. Менделеева — богатое хранилище информации о химических элементах, их свойствах и свойствах их со единений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что увеличением порядкового номера химического элемента в периодах электроотрицательность атомов увеличивается, а в группах — уменьшается.
Учитывая эти закономерности, расположите в порядке увеличения электроотрицательности следующие элементы: С, N, Si, Ge. Запишите обозначения элементов в нужной последовательности.
В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют молекулярное и ионное строение.
молекулярного строения
—при обычных условиях имеют жидкое, газообразное или твёрдое агрегатное состояние;
—имеют низкие значения температур кипения и плавления;
—имеют низкую теплопроводность.
ионного строения
—твёрдые при обычных условиях;
—хрупкие;
—тугоплавкие;
—нелетучие;
—в расплавах и растворах проводят электрический ток.
Используя данную информацию, определите, какое строение имеют вещества: серная кислота H2SO4 и гашеная известь Са(ОН)2.
1. Серная кислота H2SO4
2. Гашёная известь Са(ОН)2
В классификации сложных неорганических веществ можно выделить четыре класса, как показано на схеме. В эту схему для каждого из четырёх классов впишите пропущенные названия классов или химические формулы веществ (по одному примеру формул), принадлежащих к данному классу.
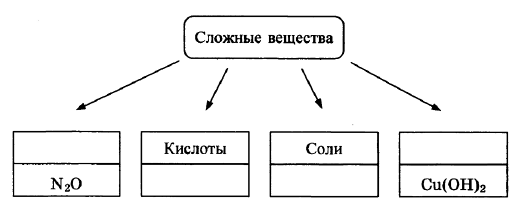
Элементы ответа:
Записаны названия классов: оксиды, основания; записаны Формулы веществ соответствующих групп.
(Допускаются иные формулировки ответа, не искажающие его смысла.)
Серная кислота (H2SO4) является одним из основных продуктов крупно- тоннажной химии. Без неё невозможно производство удобрений, полимеров, лекарств, красителей. Ежегодно во всём мире производят примерно 220 млн тонн серной кислоты.
Разбавленная серная кислота обладает всеми общими свойствами кислот, реагирует с основаниями, основными и амфотерными оксидами, гидроксидами металлов, металлами и солями. Концентрированная серная кислота — сильное дегидратирующее средство, проявляет довольно сильные окислительные свойства и способна растворять некоторые малоактивные металлы, стоящие в ряду стандартных окислительно-восстановительных потенциалов («ряд напряжений металлов») после водорода.
В одном из способов получения серной кислоты первой стадией является обжиг пирита FeS2 в присутствии кислорода воздуха. Обжиг «в кипящем слое» ведут в печах специальной конструкции. Образовавшийся сернистый газ тщательно очищают и окисляют до оксида серы(VI), который поглощают концентрированной серной кислотой. Продукт поглощения после разбавления водой превращается в серную кислоту нужной концентрации.
1) В качестве примера дегидратирующего действия серной кислоты, отмеченного в тексте, приведите уравнение реакции, происходящей при действии концентрированной H2SO4 на муравьиную кислоту при нагревании.
2) Известно, что алюминий не взаимодействует с холодной концентрированной серной кислотой. Как называется это явление?
1) 
2) Пассивация металла
1) Запишите уравнение реакции обжига пирита на воздухе.
2) Почему печь специальной конструкции называется печью для обжига в кипящем слое»?
1) 4FeS2 + 11O2 = 2Fe2O3 + 8SO2↓
2) Кипящий слой — это состояние слоя зернистого материала, при котором под влиянием проходящего через него потока воздуха частицы твёрдого материала интенсивно перемещаются одна относительно другой. В этом состоянии слой напоминает кипящую жидкость. В кипящем слое достигается тесный контакт между зёрнами пирита и кислородом, что делает более эффективным их взаимодействие
1) Запишите уравнение реакции, происходящей между раствором серной кисло ты и амфотерным гидроксидом алюминия, в кратком ионном виде.
2) Как называется продукт, получаемый при поглощении оксида серы(VI) серной кислотой?
1) Аl(OН)3 + ЗН+ = Аl3+ + ЗН2O
2) Олеум
Дана схема окислительно-восстановительной реакции:
HNO3 +H2S → H2SO4 + NO + Н20
1) Составьте электронный баланс для этой реакции.
2) Укажите окислитель и восстановитель.
3) Расставьте коэффициенты в уравнении реакции.
Элементы ответа:
1) Составлен электронный баланс:

2) Указано, что окислителем является N+5 (или азотная кислота), восстановителем — S-2 (или сероводород);
3) Составлено уравнение реакции:
8HNO3 + 3H2S = 3H2SO4 + 8NO + 4Н2O.
Дана схема превращений:
Аl → АlСl3 → Al(NO3)3 → Аl(ОН)3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
Написаны уравнения реакций, соответствующие схеме превращений:
1) 2Аl + ЗСl2 = 2АlСl3
2) АlСl3 + 3AgNO3 = Al(NO3)3 + 3AgCl↓
3) Al(NO3)3 + 3NaOH = Al(OH)3↓ + 3NaNO3
Установите соответствие между формулой органического вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) С6Н5СН3
Б) СН3СН=СНСН3
В) СН3СН(СН3)СН3
КЛАСС / ГРУППА
1) алканы
2) алкины
3) арены
4) алкены
В предложенные схемы химических реакций вставьте формулы пропущенных веществ и расставьте коэффициенты.
1) С3Н8 + _____ → С3Н7Вr + НВr
2) С5Н12 + _____ → СO2 + Н2O
Элементы ответа:
1) С3Н8 + Вг2 → С3Н7Вr + НВr
2) С5Н12 + 8О2 → 5СO2 + 6Н2O
Во многих странах этанол используют как добавку к моторному топливу, т.к. он сгорает с низким уровнем выброса токсичных веществ в атмосферу.
Какой объём кислорода (н.у.) необходим для полного сгорания 11,5 г этанола? Запишите подробное решение задачи.
1) Составлено уравнение горения спирта:
С2Н5ОН + 3О2 = 2СO2 + ЗН2O
2) n(С2Н5ОН) = m/М =11,5 г/46 г/моль = 0,25 моль
n(O2) = 3(С2Н5ОН) = 0,75 моль
3) V(O2) = п • VM = 0,75 моль • 22,4 л/моль = 16,8 л
Этанол — самый распространённый из спиртов. Он широко используется в пищевой промышленности, бытовой химии, находит разнообразные применения как растворитель. По приведённой ниже схеме составьте уравнения реакций, характеризующих химические свойства этанола. В уравнениях используйте структурные формулы органических веществ.
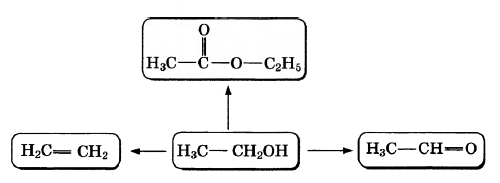
1)
2)
3)
Написаны уравнения реакций, соответствующие схеме:
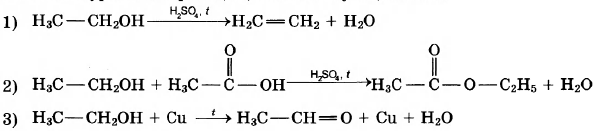
В медицинской практике широко используется раствор хлорида кальция. Рассчитайте массу кристаллогидрата этой соли (СаСl2 * 6Н2O), которая необходима для приготовления 500 г 10%-ного раствора хлорида кальция. Запишите подробное решение задачи.
1) m(CaCl2) = m(p-pa)•ω = 500 г • 0,10 = 50 г
n(СаСl2 • 6Н2O) = n(СаСl2) = m/М = 50 г/111 г/моль = 0,45 моль
2) m(СаСl2 • 6Н2O) = n • М = 0,45 моль • 219 г/моль = 98,55 г