Вариант 1
Проверочная работа включает в себя 15 заданий. На выполнение работы по химии отводится 1 час 30 минут (90 минут).
Из курса химии вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация.
На рисунках 1—3 представлены ситуации, в которых применены некоторые из перечисленных способов.

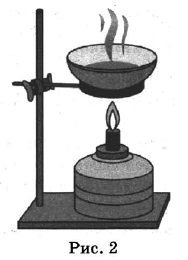

Каким из способов, которые показаны на рисунках, можно разделить смеси, чтобы отделить:
1) декан от н-пентана;
2) поваренную соль от воды?
Назовите способ, который был применён в каждом из приведённых выше примеров.
| Пример смеси | Номер рисунка | Способ очистки |
| Декан и н-пентан | ||
| Поваренная соль и вода |
| Пример смеси | Номер рисунка | Способ разделения смеси |
| Декан и н-пентан | 1 | Перегонка |
| Поваренная соль и вода | 2 | Выпаривание |
На рисунке изображена модель электронного строения атома некоторого химического элемента.
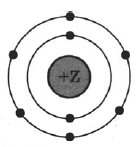
На основании анализа предложенной модели:
1) Определите химический элемент, атом которого имеет такое электронное строение.
2) Укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент.
3) Определите, к металлам или неметаллам относится простое вещество, которое образует этот химический элемент.
| Символ химического элемента | № периода | № группы | Металл/неметалл |
Периодическая система химических элементов Д.И. Менделеева богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что с увеличением порядкового номера химического элемента в периодах радиусы атомов уменьшаются, а в группах — увеличиваются.
Учитывая эти закономерности, расположите в порядке увеличения радиуса атомов следующие элементы: Li, Be, Na, Mg. Запишите обозначения элементов в нужной последовательности.
Ниже перечислены характерные свойства веществ, которые имеют молекулярное и ионное строение.
молекулярного строения
—при обычных условиях имеют жидкое, газообразное или твёрдое агрегатное состояние;
—имеют низкие значения температур кипения и плавления;
—имеют низкую теплопроводность.
ионного строения
—твёрдые при обычных условиях;
—хрупкие;
—тугоплавкие;
—нелетучие;
—в расплавах и растворах проводят электрический ток.
Используя данную информацию, определите, какое строение имеют вещества: гидроксид натрия NaOH и диоксид серы SO2. Запишите ответ в отведённом месте.
1. Гидроксид натрия NaOH
2. Диоксид серы SO2
В классификации сложных неорганических веществ можно выделить четыре класса, как показано на схеме. В эту схему для каждого из четырёх классов впишите пропущенные названия классов или химические формулы веществ (по одному примеру формул), принадлежащих к данному классу.
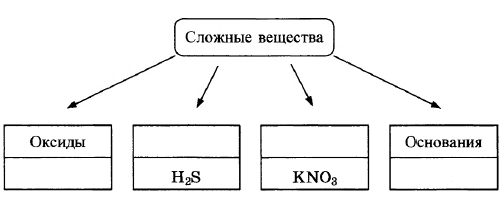
Элементы ответа:
1) Записаны названия классов: кислоты, соли;
2) записаны Формулы веществ соответствующих классов.
(Допускаются иные формулировки ответа, не искажающие его смысла.)
Оксид углерода(IV), или диоксид углерода (СO2), — газ без запаха и цвета, тяжелее воздуха, при сильном охлаждении кристаллизуется в виде белой снегообразной массы — «сухого льда». При атмосферном давлении он не плавится, а испаряется. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Растворим в воде (1 объём диоксида углерода в одном объёме воды при 15 °С).
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует кислоту. Реагирует с щёлочами с образованием карбонатов и гидрокарбонатов.
Организм человека образует приблизительно 1 кг диоксида углерода в сутки. Он переносится от тканей, где образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие.
В промышленных количествах оксид углерода(IV) содержится в дымовых газах. Он представляет собой побочный продукт химических процессов, например при разложении природных карбонатов (известняк, доломит), производства алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, который поглощает диоксид углерода, переводя его в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая диоксид углерода.
В лабораторных условиях небольшие количества его получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора или соды с соляной кислотой в аппарате Киппа. Использование серной кислоты в данном случае менее желательно.
1) Составьте молекулярное уравнение реакции взаимодействия оксида углерода (IV) с водой, которая упоминалась в тексте.
2) Приведите тривиальное название оксида углерода(IV).
Элементы ответа:
1) CO2 + H2O ⇄ H2CO3
2 ) Углекислый газ
1) Составьте молекулярное уравнение оговорённой в тексте реакции между раствором карбоната калия и оксидом углерода(IV).
2) Каков объём (н.у.) оксида углерода(IV), выделяемого организмом в сутки?
Элементы ответа:
1) К2СOO3 + СO2 + Н2O = 2КНСO3
2) V(CO2) = m/М • VM= 1000 г/44 г/моль • 22,4 л/моль = 509 л
1) Составьте сокращённое ионное уравнение оговорённой в тексте реакции между раствором карбоната калия и оксидом углерода(IV).
2) Объясните, почему нежелательно использование серной кислоты при получении оксида углерода(IV) в аппарате Киппа.
Элементы ответа:
1) СO32- + СO2 + Н2O = 2НСO3-
2 ) При использовании серной кислоты образуется малорастворимый в воде сульфат кальция. Плёнка сульфата кальция на мраморе препятствует протеканию реакции
Дана схема окислительно-восстановительной реакции:
Сu + HNO3 → Cu(NO3)2 + NO + Н2O
1) Составьте электронный баланс для этой реакции.
2) Укажите окислитель и восстановитель.
3) Расставьте коэффициенты в уравнении реакции.
Элементы ответа:
1) Составлен электронный баланс:

2) Указано, что окислителем является N+5 (или азотная кислота), восстановителем — медь Сu0
3) Составлено уравнение реакции:
ЗСu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4Н2О
Дана схема превращений:
Fe → FeCl3 → Fe(NO3)3 -> Fe(OH)3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
Написаны уравнения реакций, соответствующие схеме превращений:
1) 2Fe + ЗСl2 = 2FeCl3
2) FeCl3 + 3AgNО3 = Fe(NО3)3 + 3AgCl↓
3) Fe(NО3)3 + 3NaOH = Fe(OH)3↓ + 3NaNО3
Установите соответствие между формулой органического вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) CH3NH2
Б) СН3ОСН3
В) СН3СООСН3
КЛАСС / ГРУППА
1) спирты
2) амины
3) сложные эфиры
4) простые эфиры
В предложенные схемы химических реакций вставьте формулы пропущенных веществ и расставьте коэффициенты.
1) _____ + Са(ОН)2 → (СН3СОО)2Са + Н2O
2) С5Н12+ O2 → _____ + Н2O
1) 2СН3СООН + Са(ОН)2 → (СН3СОО)2Са + 2Н2O
2) С5Н12 + 8O2 → 5СO2 + 6Н2O
Этилен является ведущим продуктом основного органического синтеза и применяется для получения дихлорэтана, этилового спирта, стирола, уксусной кислоты и полиэтилена. Наиболее перспективным методом получения этого вещества является каталитическое разложение метана на этилен и водород.
Какая масса этилена образуется в ходе каталитического разложения метана, если при этом выделилось 0,2 м3 водорода? Запишите подробное решение задачи.
1) Составлено уравнение каталитического разложения метана:

2) n(Н2) = V/VM = 200 л /22,4 л/моль = 8,93 моль
n(C2H4) = ½ • n(Н2) = 4,46 моль
3) m(C2H4) = n • М = 4,46 моль • 28 г/моль = 124,9 г
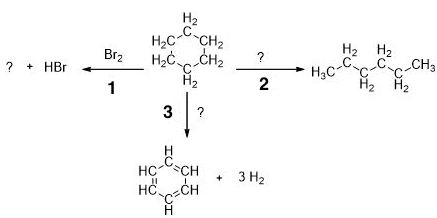
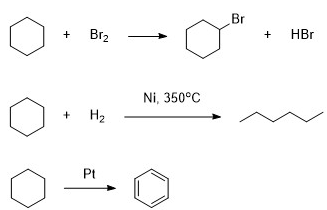
Циклогексан важное вещество в химической промышленности. Его используют для получения капролактама, бензола, циклогексанона и многого другого. В соответствии с приведённой ниже схемой замените знаки «?» на реагенты или продукты реакции. Вещества должны соответствовать номеру реакции.
В медицине широко используется раствор сульфата магния под названием «магнезия». Рассчитайте массу магнезии (MgSO4 • 7Н2O), необходимой для приготовления 400 г 25%-ного раствора сульфата магния. Запишите подробное решение задачи.
1) m(MgSO4) = m(р-ра)•ω = 400 г • 0,25 = 100 г
n(MgSO4 • 7Н2O) = n(MgSO4) = m/М = 100 г /120 г/моль = 0,83 моль
2) m(MgSO4 • 7Н2O) = n(MgSO4 • 7Н2O) • М = 0,83 моль • 246 г/моль = 204,2 г