Задание № 22176
При нагревании образца нитрата магния часть вещества разложилась. При этом образовался твёрдый остаток массой 15,4 г. Этот остаток прореагировал с 20 г 20%-ного раствора гидроксида натрия. Определите массу исходного образца нитрата магния и объём смеси газов (в пересчёте на н.у.), выделившихся при частичном разложении нитрата магния.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
[topic]
Разложение нитрата магния:
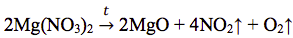
После разложения осталась смесь Mg(NO3)2 и MgO. Рассчитаем количество прореагировавшего NaOH:
m(NaOH) = m(раств.NaOH) · ω(NaOH) = 20 · 0,2 = 4 (г)
ν(NaOH) = m(NaOH) : M(NaOH) = 4 : 40 = 0,1 (моль)
С гидроксидом натрия прореагировал только нитрат магния:
Mg(NO3)2 + 2NaOH → Mg(OH)2↓ + 2NaNO3
Количество вещества нитрата магния в остатке от прокаливания:
ν(ост.Mg(NO3)2) = 0,1 : 2 = 0,05 (моль)
И его масса:
m(ост.Mg(NO3)2) = ν(ост.Mg(NO3)2) · M(Mg(NO3)
2) = 0,05 · 148 = 7,4 (г)
Тогда масса оксида магния в смеси после прокаливания:
m(MgO) = 15,4 – 7,4 = 8 (г)
Найдём массу разложившегося нитрата магния:
ν(MgO) = m(MgO) : M(MgO) = 8 : 40 = 0,2 (моль)
ν(разл.Mg(NO3)2) = ν(MgO) = 0,2 (моль)
m(разл.Mg(NO3)2) = ν(разл.Mg(NO3)2) · M(Mg(NO3)2) = 0,2 · 148 = 29,6 (г)
Масса исходной навески:
m(исх.Mg(NO3)2) = m(разл.Mg(NO3)2) + m(ост.Mg(NO3)2) = 29,6 + 7,4 = 37 (г)
Найдём количества веществ кислорода и оксида азота(IV),
выделившихся при прокаливании:
ν(NO2) = 2 · ν(MgO) = 2 · 0,2 = 0,4 (моль)
ν(O2) = 0,5 · ν(MgO) = 0,5 · 0,2 = 0,1 (моль)
Vсмесь = (ν(NO2) + ν(O2)) · VM = (0,4 + 0,1) · 22,4 = 0,5 · 22,4 = 11,2 (л)
Ответ:
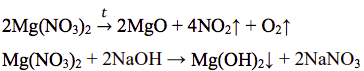
Масса исходной навески 37 г. Объём смеси выделившихся при разложении газов 11,2 л.
Ответ:Нашли ошибку в задании? Выделите фрагмент и нажмите Ctrl + Enter.