Вариант 24
Часть 1.
При выполнении заданий 1–15 укажите только одну цифру, которая соответствует номеру правильного ответа.
Число электронов в атоме равно
1) числу протонов
2) числу нейтронов
3) сумме числа протонов и нейтронов
4) числу энергетических уровней
Наименьшей восстановительной активностью обладает
1) Si
2) P
3) S
4) Cl
Веществами с ионной и ковалентной полярной связью являются соответственно
1) хлор и водород
2) сульфид калия и кислород
3) бромоводород и хлорид натрия
4) иодид кальция и хлороводород
В соединениях Cu(NO3)2 и NaNH2 степени окисления азота соответственно равны
1) +5, +3
2) +3, -3
3) +5, -3
4) -3, +5
Сернистой кислоте соответствует формула
1) H2S
2) H2SO3
3) H2SO4
4) H2S2O7
К реакциям обмена относится взаимодействие между
1) оксидом калия и водой
2) хлоридом железа(II) и хлором
3) азотной кислотой и гидроксидом бария
4) серной кислотой и магнием
Ионы ОН- образуются при диссоциации каждого из двух веществ:
1) HNO3 и NaHCO3
2) С2Н5ОН и NaOH
3) Mg(OH)Cl и H2SO4
4) NH4OH и Са(ОН)2
Газообразное вещество образуется при взаимодействии растворов
1) серной кислоты и хлорида бария
2) сульфида железа(II) и соляной кислоты
3) фосфата калия и гидроксида кальция
4) гидроксида натрия и хлорида алюминия
Практически осуществима реакция между раствором сульфата железа(II) и
1) оловом
2) свинцом
3) медью
4) цинком
В растворе едкого натра будет растворяться оксид
1) кальция
2) железа(II)
3) алюминия
4) азота(II)
Раствор азотной кислоты реагирует с каждым из двух веществ:
1) Сu и NaOH
2) N2O и CO2
3) NiO и HCl
4) Ba(NO3)2 и H2
С раствором хлорида железа(II) может реагировать
1) угарный газ
2) раствор серной кислоты
3) раствор нитрата калия
4) хлор
Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. При нагревании жидкости необходимо закрыть пробирку пробкой.
Б. При приготовлении раствора серной кислоты концентрированную кислоту необходимо добавлять в воду при перемешивании небольшими порциями.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
В уравнении окислительно-восстановительной реакции
HNO3 → NO2 + O2 + Н2O
коэффициент перед формулой восстановителя равен
1) 1
2) 2
3) 3
4) 4
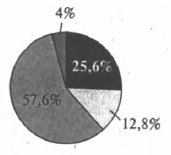
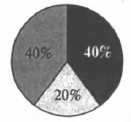
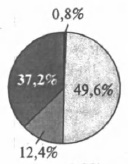
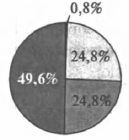
На какой диаграмме распределение массовых долей элементов отвечает качественному составу медного купороса?
1) 
2) 
3) 
4) 
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
Щелочные металлы характеризуют следующие признаки:
1) строение внешнего электронного слоя соответствует формуле ns1
2) увеличивается число неспаренных электронов в атоме
3) высшие гидроксиды проявляют свойства очень сильных оснований
4) восстановительные свойства усиливаются при уменьшении заряда ядра
5) усиливаются неметаллические свойства при увеличении порядкового номера
Сахарозу характеризуют следующие признаки:
1) взаимодействует с водой
2) является бесцветным кристаллическим веществом, растворимым в воде
3) имеет формулу СбН12O6
4) входит в состав белков
5) реагирует с хлоридом натрия
При выполнении заданий 18, 19 к каждому элементу первого первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
ВЕЩЕСТВА
А) Zn(OH)2(тв.) и ZnCl2(тв.)
Б) LiCl(тв.) и КСl(тв.)
В) NaOH и NaCl
РЕАКТИВ
1) Ba(NO3)2
2) вода дистиллированная
3) пламя
4) лакмус(р-р)
Установите соответствие между формулой соли и формулами веществ, с которыми она может взаимодействовать в водном растворе.
ФОРМУЛА СОЛИ
А) Na3PO4
Б) Na2СО3
В) NaBr
ФОРМУЛЫ ВЕЩЕСТВ
1) СН3СООН, NaNO3
2) AgNO3, ВаСl2
3) СаСО3, НСl
4) ВаСl2, СаСO3
5) KMnO4, AgNO3
Часть 2.
Для ответов на задания 20—22 используйте отдельный лист. Запишите сначала номер задания (20, 21, 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
CuS + HNO3(конц) → CuSO4 + NO2 + H2O.
Определите окислитель и восстановитель.
CuS-2 + HN+5O3(конц) → CuS+6O4 + N+4O2 + Н2O

8N+5 + S-2 = 8N+4 + S+6
N+5(HN+5O3) — окислитель
S-2(CuS-2) — восстановитель
Молекулярное уравнение
CuS + 8HNO3(конц.) = CuSO4 + 8NO2 + 4H2O
Через 40 г раствора с массовой долей гидроксида натрия 6 % пропустили углекислый газ до образования карбоната натрия. Вычислите объём (н.у.) вступившего в реакцию газа.
1) Уравнение реакции:
2NaOH + CO2 =Na2CO3 + H2O
2) Рассчитываем количество вещества NaOH: m(NaOH)конц. = 6 • 40/100 = 2,4 г
M(NaOH) = 40 г/моль, n(NaOH) = 2,4/40 = 0,06 моль.
3) Рассчитываем объём углекислого газа:
По уравнению реакции
n(СO2 = 0,5n(NaOH) = 0,03 моль
V(CO2) = 0,03 - 22,4 = 0,672 л.
Даны вещества: NaOH, CaO, CuO, Na2CO3, Na2CO3, AgNO3. Используя воду и необходимые вещества только из этого списка, получите в две стадии карбонат кальция. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
Схема эксперимента СаО -> Са(ОН)2 -> СаСO3
1) СаО + Н2O = Са(ОН)2 Реакция соединения.
2) Са(ОН)2 + Na2CO3 = СаСO3↓ + 2NaOH
Са2+ + 2OН- + [math]СО_3^{2-}[/math] = СаСO3 + 2OН-
Реакция ионного обмена. Образуется нерастворимый в воде осадок белого цвета.
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||