Вариант 21
Часть 1.
При выполнении заданий 1–15 укажите только одну цифру, которая соответствует номеру правильного ответа.
Число нейтронов в ионе 40Са+2 равно
1) 20
2) 40
3) 2
4) 4
Свойства оксидов в ряду SO3 → Р2O3 → Аl2O3 изменяются от
1) кислотных к амфотерным
2) основных к кислотным
3) амфотерных к основным
4) основных к амфотерным
Одинаковый вид химической связи имеют сульфид фосфора(V) и
1) фторид кислорода
2) сульфид натрия
3) азот
4) бромид кальция
Наименьшее значение степени окисления азот имеет в соединении
1) NH4OH
2) NaNO2
3) N2O3
4) HNO3
Сульфату меди(II) соответствует формула
1) CuS
2) CuCO3
3) CuSO3
4) CuSO4
В уравнении реакции между железом и хлором коэффициент перед формулой хлора равен
1) 6
2) 5
3) 3
4) 4
Выберите верную запись правой части уравнения диссоциации сульфита натрия.
1) = Na+ + HSO3-
2) = 2Na+ + SO42-
3) = Na+ + SO32-
4) = 2Na+ + SO32-
Необратимо протекает реакция ионного обмена между растворами
1) сульфида калия и серной кислоты
2) карбоната кальция и гидроксида калия
3) серной кислоты и нитрата меди(II)
4) соляной кислоты и ортофосфата натрия
Железо вступает в реакцию с каждым из двух веществ:
1) CuSO4 и O2
2) S и Na2SiO3
3) MgCl2 и Н2O
4) Na2SO4 и Hg(NO3)2
Какая реакция возможна?
1) CO2 + Cl2 →
2) SiO2 + Н2O →
3) SO2 + O2 →
4) Р2O5 + СO2 →
При комнатной температуре концентрированная серная кислота реагируете каждым из двух веществ:
1) железом и алюминием
2) медью и цинком
3) хромом и хлоридом калия
4) оксидом кремния и гидроксидом натрия
Химическая реакция возможна между
1) Zn и СuСl2
2) NaOH и К3РO4
3) Fe и MgSO4
4) НСl и Ba(NO3)2
Верны ли следующие суждения об использовании химических веществ?
А. Метиловый спирт является смертельно опасным веществом.
Б. Уксусная кислота используется в пищевой промышленности.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
В реакции нитрата меди(II) с железом окислителем является
1) Сu+2
2) Fe+2
3) N+5
4) O-2
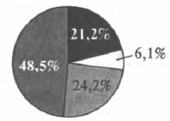
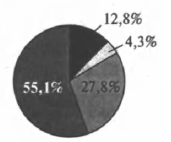
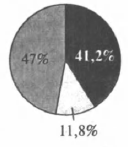
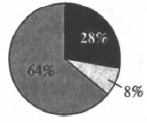
На какой диаграмме распределение массовых долей элементов отвечает качественному составу сульфида аммония?
1) 
2) 
3) 
4) 
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
В ряду химических элементов Se → S → О:
1) увеличивается степень окисления элементов в высших оксидах
2) уменьшается число неспаренных электронов в атомах
3) усиливаются неметаллические свойства
4) увеличиваются заряды ядер атомов
5) уменьшается радиус атомов
Метан:
1) относится к гомологическому ряду алкинов
2) соответствует общей формуле СnН2n
3) малорастворим в воде
4) не взаимодействует с растворами кислот и щелочей
5) обладает резким характерным запахом
При выполнении заданий 18, 19 к каждому элементу первого первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
ВЕЩЕСТВА
А) NaOH(p-p) и СН3СООН(р-р)
Б) СаВr2(тв.) и CaF2(тв.)
В) KNO3(p-p) и KCl(p-p)
РЕАКТИВ
1) фенолфталеин(р-р)
2) дистиллированная вода
3) AgNO3
4) НСl
Установите соответствие между простым веществом и реагентами, с каждым из которых оно может взаимодействовать.
НАЗВАНИЕ ВЕЩЕСТВА
А) натрий
Б) кислород
В) сера
РЕАГЕНТЫ
1) КСl, HNO3(р-р)
2) Р, O2
3) С2Н6, СН3СООН
4) СаСl2, КОН
Часть 2.
Для ответов на задания 20—22 используйте отдельный лист. Запишите сначала номер задания (20, 21, 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
Сl2 + NaOH → NaCl + NaClO3 + Н2O.
Определите окислитель и восстановитель.
[math]Сl_2^0[/math] + NaOH → NaCl- + NaCl+5O3 + Н2O
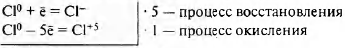
Cl0+ 5Сl0 = 5Сl- + Сl+5
Сl0(Сl2) — окислитель
Сl0(Сl2) — восстановитель
Молекулярное уравнение
ЗСl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
На мрамор, содержащий 5 % примесей, подействовали избытком 10 %-ного раствора азотной кислоты, при этом выделилось 5,6 л (при н.у.) газа. Определите массу использованного минерала.
1) Уравнение реакции:
СаСO3 + 2HNO3 = Ca(NO3)2 + CO2↑ + H2O.
2) Рассчитываем количество вещества СO2: n(СO2) = 5,6/22,4 = 0,25 моль.
3) Рассчитываем массу минерала мрамора:
а) по уравнению реакции
n(СаСO3) = n(СO2) = 0,25 моль.
М(СаСO3) = 100 г/моль, m(СаСO3) = 0,25 • 100 = 25 г
в) mсмеси = mв-ва / ω, m (мрамор) = 25/0,95 ≈ 26,3 г.
Даны вещества: Сu, ZnO, СаСO3, растворы FeCl2, НСl, NaOH. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид цинка. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
Схема эксперимента ZnO → ZnCl2 → Zn(OH)2
1) ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2H+ =Zn2+ + H2O
Вещество белого цвета (ZnO) растворяется и образуется бесцветный раствор. Реакция ионного обмена.
2) ZnCl2 + 2NaOH = Zn(OH)2↓ + 2NaCl
Zn2+ + 2OH- = Zn(OH)2
Образуется белый объёмный осадок Zn(OH)2. Реакция ионного обмена.
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||