Вариант 15
Часть 1.
При выполнении заданий 1–15 укажите только одну цифру, которая соответствует номеру правильного ответа.
Число неспаренных электронов на внешнем энергетическом уровне атома хлора в основном состоянии равно
1) 7
2) 4
3) 2
4) 1
В каком ряду химические элементы расположены в порядке усиления их металлических свойств?
1) Na → Mg → Al
2) Са → Mg → Be
3) К → Na→ Li
4) Si → Al → Mg
Веществами с ионной и ковалентной полярной связью являются соответственно
1) хлор и водород
2) сульфид натрия и кислород
3) хлороводород и фторид калия
4) иодид кальция и бромоводород
В каком из соединений степень окисления фосфора равна -3?
1) К3Р
2) Na3PO3
3) НРО3
4) Са3(РO4)2
Сложным и простым веществами соответственно являются
1) метан и алмаз
2) озон и азот
3) серная кислота и аммиак
4) красный фосфор и цинк
Верны ли следующие суждения?
А. Образование осадка соли при охлаждении раствора соли относится к химическим явлениям.
Б. Образование осадка соли при смешивании охлаждённых растворов карбоната натрия и хлорида кальция относится к физическим явлениям.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
2 моль анионов образуется при полной диссоциации 1 моль
1) хлорида кальция
2) нитрата калия
3) сульфата железа(Н)
4) карбоната натрия
Необратимо протекает реакция ионного обмена между растворами
1) хлорида калия и азотной кислоты
2) нитрата серебра и хлорида меди(Н)
3) серной кислоты и сульфата аммония
4) карбоната калия и гидроксида натрия
Цинк при обычных условиях вступает в реакцию с каждым из двух веществ:
1) оксидом углерода(IV) и кислородом
2) водородом и серой
3) кислородом и хлором
4) водой и серебром
Какая из приведённых реакций возможна?
1) CO2 + Cl2 →
2) SiO2 + Н2O →
3) SO2 + O2 →
4) Р2O5 + СO2 →
Среди веществ: Zn, Аl2O3, Сu(ОН)2, ВаСl2 — в реакцию с раствором серной кислоты вступает(-ют) вещество(-а).
1) два
2) одно
3) три
4) четыре
Промежуточным веществом X в цепочке превращений
Cu(NO3)2 → X → CuSO41) Cu2O
2) CuNO3
3) CuO
4) CuCl
Верны ли следующие суждения о чистых веществах и смесях?
А. Воздух является смесью веществ.
Б. Бензин является чистым веществом.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Процесс окисления соответствует схеме
1) N2H4 → N2
2) N2 → NH3
3) NO2 → NO
4) NO-3 → NO2
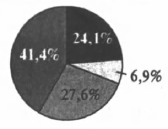
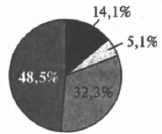
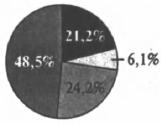
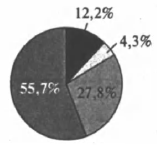
На какой диаграмме распределение массовых долей элементов отвечает количественному составу сульфита аммония?
1) 
2) 
3) 
4) 
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
Ослабление кислотных свойств высших оксидов наблюдается в рядах образующих их элементов:
1) P → S → Cl
2) Те → Se → S
3) C → Si → Ge
4) As → Se → Br
5) Si → AI → Mg
Реакция с бромной водой характерна для
1) метана
2) этилена
3) этина
4) этана
5) глицерина
При выполнении заданий 18, 19 к каждому элементу первого первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Fe(OH)2 + НСl
Б) Fe(OH)3 + NaOH
В) Fe(OH)2 + Н2O2
ПРИЗНАК ВЗАИМОДЕЙСТВИЯ
1) растворение вещества
2) изменение цвета осадка
3) образование осадка
4) выделение газа
Установите соответствие между названием вещества и реагентами, с каждым из которых оно может взаимодействовать.
НАЗВАНИЕ ВЕЩЕСТВА
А) азот
Б) кальций
В) бром
ФОРМУЛЫ РЕАГЕНТОВ
1) KOH(гор.), H2
2) O2, HCl
3) O2, Mg
4) O2, BaSO4
Часть 2.
Для ответов на задания 20—22 используйте отдельный лист. Запишите сначала номер задания (20, 21, 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
FeSO4 + КМnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
Определите окислитель и восстановитель.
Fe+2SO4 + КМn+7O4 + H2SO4 → Fe2+3(SO4)3 + Mn+2SO4 + K2SO4 + H2O
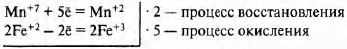
2Mn+7 + 10Fe+2 = 2Mn+2 + 10Fe+3
Мn+7 (КМn+7O4 за счёт Мn+7) — окислитель Fe+2 (Fe+2SO4 за счёт Fe+2) — восстановитель
Молекулярное уравнение
10FeSO4 + 2КМnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O.
При добавлении к раствору серной кислоты с массовой долей 10% избытка раствора хлорида бария образовался осадок массой 34,95 г. Определите массу исходного раствора серной кислоты.
1) Уравнение реакции:
H2SO4 + ВаСl2 = BaSO4↓ + 2НСl
2) Определяем количество вещества серной кислоты:
а) n = mв-ва / Mв-ва;
M(BaSO4) = 233 г/моль; n(BaSO4) = 34,95/233 = 0,15 моль
б) по уравнению реакции n(H2SO4) = n(BaSO4) = 0,15 моль
M(H2SO4) = 98 г/моль; m(H2SO4) = 0,15 • 98 = 14,7 г
3) Определяем массу раствора серной кислоты:
ω = mв-ва / mр-ра;
mp-ра(H2SO4) = 14,7 • 100/10 = 147 г.
Даны вещества: растворы Cu(NO3)2, ZnO, ZnCl2, H2SO4, MgSO4, КОН. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид цинка. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение.
Схема эксперимента ZnO → ZnSO4 → Zn(OH)2
1) ZnO + H2SO4 = ZnSO4 + H2O
ZnO + 2H+ = Zn2+ + H2O
Реакция ионного обмена. Оксид цинка — вещество белого цвета, растворяется в серной кислоте и образуется бесцветный прозрачный раствор.
2) ZnSO4 + 2КОН = Zn(OH)2↓ + K2SO4
Zn2+ + 2OH- = Zn(OH)2
Реакция ионного обмена. При добавлении в раствор сульфата цинка раствора гидроксида калия образуется объёмный осадок белого цвета.
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||