Вариант 5
Часть 1.
При выполнении заданий 1–15 укажите только одну цифру, которая соответствует номеру правильного ответа.
Химическому элементу, в атоме которого распределение электронов по слоям 2е, 8е, 7е, соответствует символ этого элемента, формула высшего оксида и водородного соединения:
1) Сl,Сl2O,НСl
2) С, СO2, СН4
3) Сl,Сl2O7,НСl
4) N, N2O5, NH3
Амфотерным является высший оксид каждого из , имеющих в порядковые номера:
1) 4,13, 30
2) 6, 11, 16,
3) 19,12, 3
4) 6, 14, 17
Ковалентной неполярной связью образовано каждое из веществ в группе:
1) СO2, SiCl4, НВr
2) H2, O2, S8
3) Fe2O3, CaS, К2O
4) НСl, NaCl, PH3
Максимально возможную степень окисления атом серы проявляет в соединении
1) H2S
2) K2SO3
3) FeS2
4) Li2S
Сложным является каждое из двух веществ:
1) вода и хлор
2) вода и водород
3) водород и кварц
4) бензол и вода
Признаком химической реакции между растворами сульфата меди(II) и гидроксида калия является:
1) выделение газа
2) выпадение осадка
3) появление запаха
4) поглощение теплоты
Сульфит-ионы образуются при электролитической диссоциации
1) MgSO4
2) K2SO3
3) SrSO3
4) Li2S
Краткое ионное уравнение Н+ + ОН = Н2O отвечает взаимодействию веществ:
1) Н2СO3 и КOН
2) Н3РO4 и Fe(OH)2
3) НСl и КОН
4) НСl и Fe(OH)3
Не взаимодействуют между собой вещества, формулы которых:
1) Аl и Н2SO4(конц.)
2) Аl и NaOH(p-p)
3) Zn и CuSO4(p-p)
4) Сu и HNO3(кoнц.)
Две соли образуются при растворении в соляной кислоте оксида
1) Fe2O3
2) Аl2O3
3) ZnO
4) Fe3O4
Гидроксид железа(II) реагирует с раствором
1) сульфата натрия
2) карбоната калия
3) хлорида кальция
4) бромоводорода
Соль не образуется в ходе реакции
1) Fe + Сl2 →
2) Fe + НСl →
3) СаСO3 + Н2О + СО2 →
4) Cu(NO3)2 
Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Полученный из пероксида водорода кислород нельзя определить по запаху.
Б. Водород, полученный в результате взаимодействия цинка с соляной кислотой, при поджигании не надо проверять на чистоту.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
В уравнении окислительно-восстановительной реакции
Сu + H2SO4 → CuSO4 + Н2O + SO2
коэффициент перед формулой восстановителя равен
1) 4
2) 3
3) 2
4) 1
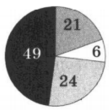
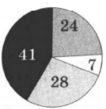
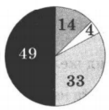
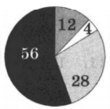
На какой диаграмме распределение массовых долей элементов соответствует количественному составу сульфата аммония:
1) 
2) 
3) 
4) 
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
Общим для серы и хлора является
1) одинаковое значение электроотрицательности
2) образование ими высших оксидов с общей формулой ЭO3
3) наличие трёх электронных слоёв в их атомах
4) одинаковое число электронов на внешнем электронном слое
5) способность взаимодействовать с большинством металлов
Уксусная кислота не вступает во взаимодействие с
1) оксидом углерода(IV)
2) оксидом кальция
3) медью
4) гидроксидом натрия
5) карбонатом калия
При выполнении заданий 18, 19 к каждому элементу первого первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. К каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
ВЕЩЕСТВА
А) АlВг3(р-р) и AgNO3(p-p)
Б) ВаСl2(р-р) и H2SO4(p-p)
В) Аl(ОН3)(р-р) и Mg(OH)2(p-p)
РЕАКТИВ
1) HCl (p-p)
2) Na2SO4
3) HNO3(p-p)
4) NaOH
Установите соответствие между названием вещества и , с которыми это вещество может взаимодействовать.
НАЗВАНИЕ ВЕЩЕСТВА
А) бром
Б) HF
В) иодид натрия
РЕАГЕНТЫ
1) Са, NaF(p-p)
2) Br2, AgNO3(p-p)
3) SiO2, Mg
4) KI(p-p), Аl
Часть 2.
Для ответов на задания 20—22 используйте отдельный лист. Запишите сначала номер задания (20, 21, 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
FeCl3 + H2S → НСl + S + FeCl2
Определите окислитель и восстановитель.
1. Составлен электронный баланс.
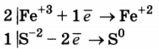
2) Расставлены коэффициенты в уравнении реакции:
2FeCl3 + H2S = 2НСl + S + 2FeCl2
3) Указано, что восстановителем является S-2, а окислителем Fe+3.
При растворении 180 г известняка в избытке азотной кислоты выделилось 34,27 л (н.у.) углекислого газа. Определите массовую долю карбоната кальция в данном образце известняка.
1) Уравнение реакции:
CaCO3 + 2HNO3 = Ca(NO3)2 + CO2↑ + H2O
2) Рассчитываем количество вещества CO2:
n(CO2) = V/Vm =34,27л/22,4л/моль ≈ 1,53 моль
3) Рассчитываем массу CaCO3(чист.):
а) по уравнению реакции: n(CaCO3(чист.)) = n(CO2) = 1,53 моль
б) M(CaCO3) = 100 г/моль, m(CaCO3(чист.)) = n*M = 1,53 моль * 100 г/моль = 153 г
4) Рассчитываем массовую долю CaCO3:
ω(CaCO3)= 153г/180г *100% = 85%
Даны вещества: Fe, НСl(разб.), Сu, К3РO4, (СuOH)2СO3, NaOH. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид меди(II). Опишите признаки проводимых реакций. Для первой реакции напишите сокращённое ионное уравнение.
Составлены два уравнения реакции:
1) (СuOH)2CO3 + 4НСl = 2CuCl2 + ЗН2O + СO2 ↑
2) CuCl2 + 2NaOH = Cu(OH)2 ↓ + 2NaCl
Описаны признаки протекания реакций:
3) для первой реакции: растворение соли и выделение бесцветного газа;
4) для второй реакции: образование голубого осадка гидроксида меди.
Составлено сокращённое ионное уравнение первой реакции:
5) (CuOH)2CO3 + 4Н+ = 2Сu2+ + ЗН2O + СO2 ↑
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||