Вариант 4
Часть 1.
При выполнении заданий 1–15 укажите только одну цифру, которая соответствует номеру правильного ответа.
На приведенном рисунке
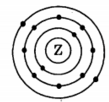
изображена модель атома
1) магния
2) кальция
3) лития
4) калия
В каком ряду элементы расположены в порядке уменьшения их электроотрицательности
1) азот — углерод — бор
2) кремний — фосфор — сера
3) германий — кремний — углерод
4) фтор — бром — хлор
Соединениями с ковалентной неполярной и ионной связью являются соответственно
1) оксид фосфора и оксид натрия
2) хлорид натрия и хлор
3) азот и сульфид натрия
4) хлорид кальция и хлороводород
Валентность каждого из элементов равна II в веществе
1) AlN
2) H2O2
3) H2S
4) MgS
К кислотным оксидам относится каждое из двух веществ:
1) ZnO, Cl2O
2) MgO, ZnO
3) CO, CO2
4) Cl2O7, SO3
Взаимодействие алюминия с оксидом железа(III) относится к реакциям
1) соединения
2) обмена
3) окислительно-восстановительным
4) нейтрализации
Электролитической диссоциации ортофосфорной кислоты по третьей ступени отвечает уравнение:
1) Н3РO4 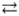 2Н+ + HPO42-
2Н+ + HPO42-
2) Н2РО4 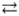 Н+ + НРО42-
Н+ + НРО42-
3) Н3РО4 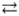 ЗН+ + РО43-
ЗН+ + РО43-
4) HPO42- 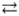 Н+ + РО43-
Н+ + РО43-
Взаимодействию нитрата серебра и хлорида натрия отвечает краткое ионное уравнение:
1) NO3 + Na+ = NaNO3
2) AgNO3 + Сl- = AgCl + NO3
3) Ag+ + NaCl = AgCl + Na+
4) Ag+ + Сl- = AgCl
Магний легко растворяется в
1) дистиллированной воде
2) аммиачной воде
3) растворе НСl
4) растворе Na2CO3
Оксид цинка взаимодействует с каждым из веществ:
1) Н2O, Fe
2) HNO3, С
3) НСl, Сu
4) NaOH, O2
Сероводородная кислота реагирует с каждым из веществ:
1) HCl и O2
2) NaOH и NaCl
3) Н3РО4 и КОН
4) NaOH и Аl(ОН)3
Хлорид меди(II) не реагирует с
1) H2S
2) K2S
3) H2CO3
4) AgNO3
Верны ли следующие суждения об обращении с газами в процессе лабораторных опытов?
А. Прежде чем поджечь водород, его необходимо проверить на чистоту.
Б. Получаемый из бертолетовой соли хлор нельзя определять по запаху.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
В уравнении окислительно-восстановительной реакции
Cu(NO3)2 → CuO + NO2 + O2
коэффициент перед формулой окислителя равен
1) 1
2) 2
3) 3
4) 4
Массовая доля кислорода в нитрате железа(III) равна
1) 59,5%
2) 6,6%
3) 16,0%
4) 56,1%
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
В ряду химических элементов F — Сl — Вг
1) уменьшается электроотрицательность
2) увеличивается сила образуемых кислородсодержащих кислот
3) увеличивается сила образуемых бескислородных кислот
4) уменьшается радиус атомов
5) увеличивается значение высшей степени окисления
Для жиров верны следующие утверждения:
1) при обычных условиях — твердые вещества
2) входят в состав растительных и животных организмов
3) растворяются в воде
4) обладают моющими свойствами
5) являются одним из источников энергии для живых организмов
При выполнении заданий 18, 19 к каждому элементу первого первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. К каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
ВЕЩЕСТВА
А) CuSO4(p-p) и СuСl2(р-р)
Б) Na2SO4(тв.) и BaSO4(тв.)
В) NH3(p-p) и NH4Cl(p-p)
РЕАКТИВ
1) Н2O
2) фенолфталеин
3) Ba(NO3)2(p-p)
4) Сu
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
НАЗВАНИЕ ВЕЩЕСТВА
А) углерод
Б) оксид натрия
В) хлорид аммония
РЕАГЕНТЫ
1) NaOH(p-p), AgNO3(p-p)
2) СO2, Са
3) P2O5,H2SO4
4) S, Н2O
Часть 2.
Для ответов на задания 20—22 используйте отдельный лист. Запишите сначала номер задания (20, 21, 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
Р + HNO3 → Н3РО4 + NO2 + Н2O
Определите окислитель и восстановитель.
1. Составлен электронный баланс.
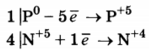
2) Расставлены коэффициенты в уравнении реакции:
Р + 5HNO3 = Н3РO4 + 5NO2 + Н2O
Указано, что восстановителем является Р0, а окислителем N+5.
При взаимодействии 30,93 г руды, содержащей карбонат железа(II), с избытком соляной кислоты выделилось 4,48 л углекислого газа. Определите массовую долю примесей в руде.
1) Уравнение реакции:
FeCO3 + 2HCl = FeCl2 + CO2↑ + H2O
2) Рассчитываем количество вещества CO2:
n(CO2) = V/Vm =4,48л/22,4л/моль = 0,2 моль
3) Рассчитываем массу FeCO3(чист.):
а) по уравнению реакции: n(FeCO3(чист.)) = n(CO2) = 0,2 моль
б) M(FeCO3) = 116 г/моль, m(FeCO3(чист.)) = n*M = 0,2 моль * 116 г/моль = 23,2 г
4) Рассчитываем массу примесей:
m(примесей) = 30,93 г - 23,2 г = 7,73 г
5) Рассчитываем массовую долю примесей:
ω(примесей) = 7,73г/30,93г *100% = 25%
Даны вещества: Zn, НСl(разб.), NaCl, К3РO4, NaOH, CuO. Используя воду и необходимые вещества только из этого списка, получите в две стадии медь. Опишите признаки проводимых реакций. Для реакции замещения напишите сокращённое ионное уравнение.
Составлены два уравнения реакции:
CuO + 2НС1 = СuСl2 + Н2O
СuСl2+ Zn = ZnCl2 + Сu
Описаны признаки протекания реакций:
3) для первой реакции: растворение осадка и появление синеватозелёной окраски раствора;
4) для второй реакции: цементация на цинке красного осадка меди.
Составлено сокращённое ионное уравнение второй реакции:
5) Cu2+ + Zn = Zn2+ + Сu
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||