Вариант 1
Часть 1.
При выполнении заданий 1–15 укажите только одну цифру, которая соответствует номеру правильного ответа.
Четыре электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1) С, Si, Sn
2) О, Cl, I
3) N, C, S
4) Mg, Be, Ca
В каком ряду химических элементов ослабевают неметаллические свойства соответствующих им простых веществ:
1) сера — фосфор — кремний
2) селен — сера — кислород
3) бор — углерод — азот
4) кремний — фосфор — сера
Химическая связь в кристалле оксида кальция:
1) ковалентная неполярная
2) ковалентная полярная
3) металлическая
4) ионная
Степень окисления -2 атом серы проявляет в каждом из соединений:
1) CaSO3 и H2S
2) H2SO4 и FeS
3) SO2 и H2S
4) CaS и H2S
К солям относится каждое из двух веществ:
1) FeCl2 и Ba(NO3)2
2) Ca(NO3)2 и H2SO4
3) КОН и Li2SO4
4) СаО и NaCl
Признаком химической реакции между растворами нитрата серебра и хлорида алюминия является:
1) изменение цвета
2) выделение газа
3) появление запаха
4) выпадение осадка
Наибольшее число молей катионов и анионов образуется при полной диссоциации в водном растворе 1 моль:
1) FeCl2
2) KOH
3) Na3PO4
4) H2SO4
Краткое ионное уравнение Н+ + ОН- = Н2O отвечает взаимодействию веществ:
1) H2S и KOH
2) H2S и Cu(OH)2
3) HNO3 и Ва(ОН)2
4) HNO3 и Zn(OH)2
Не реагируют друг с другом
1) хлор и кислород
2) азот и водород
3) сера и железо
4) бром и кальций
Оксид серы(VI) взаимодействует с каждым из двух веществ:
1) вода и хлорид натрия
2) оксид кальция и раствор гидроксида натрия
3) кислород и оксид магния
4) вода и серебро
Гидроксид железа(III) в отличие от гидроксида натрия
1) легко растворяется в H2SO4
2) разлагается при небольшом нагревании
3) взаимодействует с фосфорной кислотой
4) реагирует с алюминием
Сульфат натрия реагирует с
1) КОН
2) Ва(ОН)2
3) NaCl
4) Н2СO3
Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Пламя спиртовки можно затушить, накрыв его колпачком.
Б. Горящий натрий можно затушить водой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
В уравнении окислительно-восстановительной реакции
NO2 + Mg → MgO + N2
коэффициент перед формулой окислителя равен
1) 4
2) 3
3) 2
4) 1
Массовая доля серы в сульфате алюминия равна
1) 28,1%
2) 9,4%
3) 64,0%
4) 32,0%
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
В ряду химических элементов В — С — N
1) увеличивается заряд ядер атомов
2) усиливаются кислотные свойства образуемых гидроксидов
3) увеличивается число электронных уровней
4) уменьшается электроотрицательность
5) возрастает атомный радиус
Для этилена верны следующие утверждения:
1) относится к непредельным углеводородам
2) не реагирует с кислородом
3) реагирует с водородом
4) имеет только одинарные связи
5) вступает в реакции замещения
При выполнении заданий 18, 19 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. К каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
ВЕЩЕСТВА
А) KCl(p-p) и КI(р-р)
Б) Al(NO3)3 и AI2(SO4)3(p-p)
В) Аl(ОН)3(тв) и Mg(OH)2(тв)
РЕАКТИВ
1) AgNO3 (р-р)
2) ВаСl2 (р-р)
3) КОН (р-р)
4) NH3 (р-р)
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать:
НАЗВАНИЕ ВЕЩЕСТВА
А) оксид углерода(II)
Б) оксид углерода(IV)
В) карбонат натрия
РЕАГЕНТЫ
1) Ва(ОН)2 (р-р), Mg
2) СО2(р-р), HCl(p-p)
3) Fe2O3, O2
4) H2O,SO2
Часть 2.
Для ответов на задания 20—22 используйте отдельный лист. Запишите сначала номер задания (20, 21, 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
NH3 + CuO → N2 + Н2O + Сu
Определите окислитель и восстановитель.
1. Составлен электронный баланс
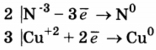
2. Расставлены коэффициенты в уравнении реакции:
2NH3 + ЗСuО = N2 + ЗН2O + ЗСu
3. Указано, что восстановителем является N-3, а окислителем Сu2+.
При взаимодействии 150 г раствора нитрата свинца с небольшим избытком раствора иодида калия выпало 10,45 г осадка. Рассчитайте массовую долю нитрата свинца в исходном растворе.
1) Уравнение реакции:
Pb(NO3)2 + 2KI = 2KNO3 + PbI2↓
2) Рассчитываем количество вещества PbI2:
М(PbI2) = 461 г/моль, n(PbI2) = m/M = 10,45г/461г/моль ≈ 0,023 моль
3) Рассчитываем массу Pb(NO3)2 в растворе:
а) по уравнению реакции: n(PbI2) = n(Pb(NO3)2) = 0,023 моль
б) M(Pb(NO3)2) = 331 г/моль, m(Pb(NO3)2) = n*M = 0,023 моль * 331 г/моль ≈ 7,6 г
3) Рассчитываем массовую долю Pb(NO3)2 в растворе:
ω = m(р. в-ва)/m(р-ра) *100%, ω(Pb(NO3)2) = 7,6г/150г *100% = 5%
Даны вещества: Zn, Н2SO4(разб.), Fe, Сu, NaOH, CuSO4. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид цинка(II). Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
Составлены два уравнения реакции:
1) Zn + H2SO4 = ZnSO4 + Н2 ↑
2) ZnSO4 + 2NaOH = Zn(OH)2 ↓ + Na2SO4
Описаны признаки протекания реакций:
3) для первой реакции: выделение бесцветного газа;
4) для второй реакции: образование белого аморфного осадка. Составлено сокращённое ионное уравнение второй реакции:
Zn2+ + 2OН- = Zn(OH)2↓
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||