Вариант 16
Часть 1.
При выполнении заданий 1–15 укажите только одну цифру, которая соответствует номеру правильного ответа.
На приведённом рисунке
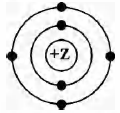
изображена модель атома химического элемента
1) 2-го периода VIA группы
2) 3-го периода IVA группы
3) 3-го периода VIA группы
4) 2-го периода IVA группы
В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1) As → Р → S
2) О → S → Se
3) I → Вr → Сl
4) Be → В → С
Какое из указанных веществ имеет металлическую связь?
1) Be
2) BaS
3) N2
4) Na2O
Такую же степень окисления, как и в СН4, углерод имеет в соединении
1) CO
2) Al4C3
3) CaCO3
4) CO2
Кислотному оксиду и кислоте соответствуют формулы
1) N2O и HNO3
2) СO2 и СН4
3) ВеО и Ве(ОН)2
4) SO2 и H2S
В реакцию разложения, протекающую без изменения степени окисления, вступает
1) Н2О
2) Fe(OH)3
3) H2O2
4) КМnO4
В водном растворе полностью диссоциирует на ионы
1) азотная кислота
2) сероводород
3) глицерин
4) этиловый спирт
При взаимодействии каких ионов в растворе образуется газ?
1) H+ и СO32-
2) Na+ и СO32-
3) Zn2+ и OH-
4) Ba2+ и SO42-
Хлор взаимодействует с каждым из веществ в ряду
1) O2, P
2) KOH, FeCl2
3) Ca(OH)2, N2
4) Mg, SO3
Химическая реакция возможна между
1) оксидом углерода(IV) и серебром
2) оксидом алюминия и водой
3) оксидом натрия и гидроксидом кальция
4) оксидом кремния и гидроксидом калия
Верны ли следующие суждения о свойствах щелочей?
А. Растворы щелочей не вступают в реакцию с алюминием.
Б. Гидроксид калия реагирует с гидроксидом алюминия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
В реакцию и с гидроксидом кальция, и с нитратом бария вступает
1) карбонат бария
2) сульфат аммония
3) хлорид натрия
4) сульфид железа(II)
Верны ли следующие суждения о назначении химического оборудования и составе средств гигиены?
А. Пробирка с газоотводной трубкой используется для отвода теплоты, выделяющейся в ходе химической реакции.
Б. Зубная паста, содержащая ионы кальция, способствует укреплению зубной эмали.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
В реакции оксида железа(III) с оксидом углерода(II) окислителем является
1) Fe0
2) C+4
3) Fe+3
4) C+2
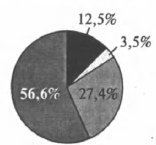
На какой диаграмме распределение массовых долей элементов отвечает количественному составу дигидрофосфата аммония?
1) 
2) 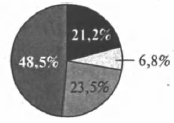
3) 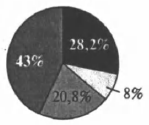
4) 
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифры, под которыми они указаны.
В ряду химических элементов N → Be → Li:
1) уменьшается радиус атомов
2) усиливаются металлические свойства
3) уменьшаются заряды ядер атомов
4) увеличивается число электронов во внешнем электронном слое атомов
5) уменьшается восстановительная активность
α-Аминокислоты характеризует следующее:
1) входят в состав ДНК и РНК
2) нерастворимые в воде вещества
3) остатки α-аминокислот входят в состав белков
4) реагируют и со щелочами, и с кислотами
5) основной источник энергии в организме
При выполнении заданий 18, 19 к каждому элементу первого первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) К2Сr2O7 + NaOH
Б) NH4Cl + NaOH
В) Са(ОН)2 (р-р) + СO2
ПРИЗНАК ВЗАИМОДЕЙСТВИЯ
1) выделение газа с резким запахом
2) помутнение раствора
3) изменение окраски раствора
4) растворение вещества и изменение окраски раствора
Установите соответствие между названиями оксидов и перечнем веществ, с которыми они могут взаимодействовать.
НАЗВАНИЕ ОКСИДА
А) оксид углерода(IV)
Б) оксид меди(II)
В) оксид кальция
ВЕЩЕСТВА
1) СО, HNO3
2) Mg, Са(ОН)2
3) КОН, Сl2
4) Н2O, SiO2
Часть 2.
Для ответов на задания 20—22 используйте отдельный лист. Запишите сначала номер задания (20, 21, 22), а затем развернутый ответ к нему. Ответы записывайте четко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
H2S + Сl2 + Н2O → H2SO4 + НСl.
Определите окислитель и восстановитель.
H2S-2 + [math]Cl_2^0[/math] + Н2O → H2S+6O4 + НСl-

4[math]Cl_2^0[/math] + S-2 = 8Сl- + S+6
Сl0 ([math]Cl_2^0[/math]) — окислитель
S-2 (H2S-2 за счёт S-2) — восстановитель
Молекулярное уравнение: H2S + 4Сl2 + 4Н2O = H2SO4 + 8НСl.
36,5 г раствора соляной кислоты смешали с избытком раствора нитрата серебра. Выпал осадок массой 8,61 г. Вычислите массовую долю кислоты в растворе.
1) Уравнение реакции
AgNO3 + НСl = AgCl↓ + HNO3
2) Рассчитываем массу НСl:
а) количество вещества AgCl
n = mв-ва / Мв-ва
M(AgCl) = 143,5 г/моль; n(AgCl) = 8,61/143,5 = 0,06 моль
б) по уравнению реакции n(HCl) = n(AgCl) = 0,06 моль
М(НСl) = 36,5 г/моль; m(НСl) = 0,06 • 36,5 = 2,19 г
3) Рассчитываем массовую долю НСl:
ω = mв-ва / mр-ра; ω(HCl) = 2,19/36,5 = 0,06, или 6,0%.
Даны следующие вещества: H2SO4, Н2O2, Mg3(PO4)2, Cu(OH)2, MgCO3, КОН. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид магния. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение.
Схема эксперимента MgCO3 → MgSO4 Mg(OH)2
1) MgCO3 + H2SO4 = MgSO4 + H2O + CO2↑
MgCO3 + 2H+ = Mg2+ + H2O + CO2
Реакция ионного обмена. Выделяется газ.
2) MgSO4 + 2КОН = Mg(OH)2↓ + K2SO4
Mg2+ + 2OH- = Mg(OH)2
Реакция ионного обмена. Образуется осадок белого цвета.
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||