Вариант 4
Проверочная работа включает в себя 15 заданий. На выполнение работы по химии отводится 1 час 30 минут (90 минут).
Из курса химии вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация.
На рисунках 1-3 представлены ситуации, в которых применены некоторые из перечисленных способов.



Каким из способов, которые показаны на рисунках, можно разделить смеси, чтобы отделить:
1) кварцевый песок от речной воды;
2) раствор сульфата натрия от осадка гидроксида железа(III)?
Назовите способ, который был применён в каждом из приведённых выше примеров.
| Смесь | Номер рисунка | Способ разделения смеси |
| Кварцевый песок и речная вода | ||
| Раствор сульфата натрия и осадок гидроксида железа(III) |
| Смесь | Номер рисунка | Способ разделения смеси |
| Кварцевый песок и речная вода | 1 | Отстаивание |
| Раствор сульфата натрия и осадок гидроксида железа(III) | 2 | Фильтрование |
На рисунке изображена модель электронного строения атома некоторого химического элемента.
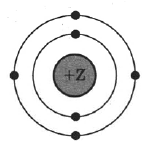
На основании анализа предложенной модели:
1) Определите химический элемент, атом которого имеет такое электронное строение.
2) Укажите номер периода и номер группы в Периодической системе химических элементов Д.И. Менделеева, в которых расположен этот элемент.
3) Определите валентность элемента в его высшем оксиде.
| Символ химического элемента | № периода | № группы | Металл/неметалл |
Периодическая система химических элементов Д.И. Менделеева — богатое хранилище информации о химических элементах, их свойствах и свойствах их соединений, о закономерностях изменения этих свойств, о способах получения веществ, а также о нахождении их в природе. Так, например, известно, что с увеличением порядкового номера химического элемента в периодах радиусы атомов уменьшаются, а в группах — увеличиваются.
Учитывая эти закономерности, расположите в порядке уменьшения радиуса атомов следующие элементы: О, F, S, Сl. Запишите обозначения элементов в нужной последовательности.
Ниже перечислены характерные свойства веществ, которые имеют молекулярное и атомное строение.
молекулярного строения
—при обычных условиях имеют жидкое, газообразное или твёрдое агрегатное состояние;
—имеют низкие значения температур кипения и плавления;
—имеют низкую теплопроводность.
ионного строения
—твёрдые при обычных условиях;
—хрупкие;
—тугоплавкие;
—нелетучие;
—в расплавах и растворах проводят электрический ток.
Используя данную информацию, определите, какое строение имеют вещества: сера S8 и кварц SiO2.
1. Cepa S8
2. Кварц SiO2
В классификации сложных неорганических веществ можно выделить четыре класса, как показано на схеме. В эту схему для каждого из четырёх классов впишите пропущенные названия классов или химические формулы веществ (по одному примеру формул), принадлежащих к данному классу.
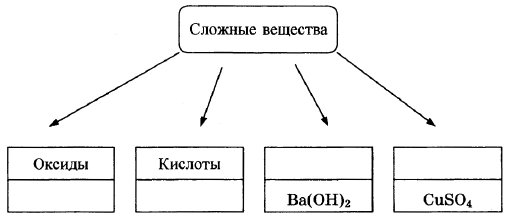
Элементы ответа:
Записаны названия классов: основания, соли; записаны формулы веществ соответствующих групп.
(Допускаются иные формулировки ответа, не искажающие его смысла.)
Азотная кислота (HNO3) — одноосновная кислота, которую раньше получали взаимодействием концентрированной серной кислоты при нагревании с сухим нитратом калия. Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы.
Азотная кислота — бесцветная, дымящая на воздухе жидкость, температура плавления 41,6 °С, кипения +82,6 °С. Высококонцентрированная HN03 имеет обычно бурую окраску вследствие происходящего на свету или при нагревании процесса разложения.
Азотную кислоту можно перегонять без разложения только при пониженном давлении. Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
HNO3 как одноосновная кислота взаимодействует с основными и амфотерными оксидами, основаниями, вытесняет слабые кислоты из их солей. Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя за счёт азота в степени окисления +5. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты.
1) Составьте оговоренное в тексте молекулярное уравнение реакции азотной кислоты с оксидом железа(III).
2) К каким реакциям относится взаимодействие оксида железа с азотной кисло той — экзотермическим или эндотермическим?
1) Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
2) Экзотермическая реакция
1) Составьте молекулярное уравнение оговорённой в тексте реакции разложения азотной кислоты.
2) Почему концентрированная азотная кислота имеет бурую окраску?
1) 4HNO3 = 2Н2O + O2 + 4NO2
2) Бурая окраска концентрированной азотной кислоты связана с цветом NO2, который образуется при разложении кислоты
1) Составьте сокращённое ионное уравнение реакции между раствором азотной кислоты и ацетатом натрия.
2) Приведите формулу продукта восстановления азотной кислоты, образующего ся при растворении серебра в концентрированной HNO3.
1) Н+ + СН3СОО- = СН3СОН
2) NO2 — продукт восстановления азотной кислоты, образующийся при взаимодействии её с серебром
Дана схема окислительно-восстановительной реакции:
МnСO3 + КСlO3 → МnO2 + КСl + СO2
1) Составьте электронный баланс для этой реакции.
2) Укажите окислитель и восстановитель.
3) Расставьте коэффициенты в уравнении реакции.
Элементы ответа:
1) Составлен электронный баланс:

2) Указано, что окислителем является Сl+5 (или хлорат калия), восстановителем — Мn+2 (или карбонат марганца);
3) Составлено уравнение реакции:
ЗМnСО3 + КСlO3 = 3MnO2 + КСl + ЗСO2
Дана схема превращений:
Mg → MgSO4 → Mg(NO3)2 → Mg(OH)2
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
1) Mg + H2SO4 = MgSO4 + H2↑
2) MgSO4 + Ba(NO3)2 = Mg(NO3)2 + BaSO4↓
3) Mg(NO3)2 + 2NaOH = Mg(OH)2↓ + 2NaNO3
Установите соответствие между формулой органического вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) СН3—СН2—СН2—СН8
Б) СН3—СН=СН—СН3
В) СН3—СООН
КЛАСС / ГРУППА
1) предельные углеводороды
2) спирты
3) непредельные углеводороды
4) карбоновые кислоты
В предложенные схемы химических реакций вставьте формулы пропущенных веществ и расставьте коэффициенты.
1) С2Н5ОН+ ____ → C2H5ONa + Н2
2) С6Н6 + ____ → СO2 + Н2O
1) 2С2Н5ОН+ 2Na → 2C2H5ONa + Н2
2) 2С6Н6 + 15O2 → 12СO2 + 6Н2O
Реакции крекинга (расщепления молекул углеводородов на два примерно одинаковых фрагмента) лежат в основе вторичной переработки нефти, цель которой — превращение тяжелых нефтяных фракций в бензин.
Какая масса пентана образуется в ходе крекинга 56,8 г декана? Запишите подробное решение задачи.
1) Составлено уравнение крекинга декана:

2) n(С10Н22) = m/М = 56,8 г/142 г/моль= 0,4 моль
n(С5Н12) = n(С10Н22) = 0,4 моль.
3) m(С5Н12) = n • М= 0,4 моль • 72 г/моль = 28,8 г
Пропен — один из важнейших алкенов, он широко используется для получения изопропилового спирта и ацетона, полипропилена, пластмасс, каучуков, моющих средств, растворителей. По приведённой ниже схеме составьте уравнения реакций, характеризующих химические свойства пропена. В уравнениях используйте структурные формулы органических веществ.
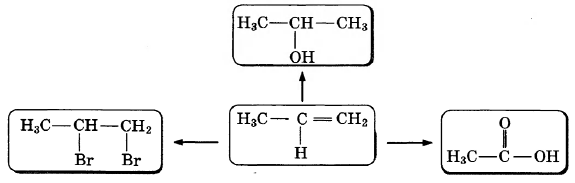
1)
2)
3)
В сельском хозяйстве для борьбы с грибковыми заболеваниями растений используют 5%-ный раствор сульфата меди. Рассчитайте массу медного купороса (CuSO4 • 5Н2O), которую следует взять для получения 1000 г 5%-ного раствора сульфата меди. Запишите подробное решение задачи.
1) m(CuSO4) = m(р-ра) •ω = 1000 г • 0,05 = 50 г
n(CuSO4 • 5Н2O) = n(CuSO4) = m/М = 50 г/160 г/моль = 0,31 моль
2) m(CuSO4 • 5Н2O) = n(CuSO4 • 5Н2O) • М = 0,31 моль • 250 г/моль = 77,5 г