Демонстрационный по химии
Часть 1.
Ответом к заданиям 1–5, 7–10, 12–17 является одна цифра, которая соответствует номеру правильного ответа. Для вашего удобства данные задания оснастили радио-кнопками. Работать со смартфона будет проще. Ответом к заданию 6 являются три цифры, которые соответствуют номерам правильных ответов. Запишите эти цифры в поле ответа в тексте работы. Ответом к заданиям 11 и 18 являются две цифры, которые соответствуют номерам правильных ответов. ответом к заданиям 24–26 является число. Запишите полученное число с указанной степенью точности в поле ответа.
Одинаковое число электронов содержат частицы
1. Al3+ и N-3
2. Ca2+ и Cl+5
3. S0 и CI-
4. N-3 и p-3
В ряду элементов
Na → Mg → Al → Si
1. уменьшаются радиусы атомов
2. уменьшается число протонов в ядрах атомов
3. увеличивается число электронных слоёв в атомах
4. уменьшается высшая степень окисления атомов
Химическая связь в метане и хлориде кальция соответственно
1. ковалентная полярная и металлическая
2. ионная и ковалентная полярная
3. ковалентная неполярная и ионная
4. ковалентная полярная и ионная
Степень окисления +7 хлор имеет в соединении
1. Ca(ClO2)2
2. HClO3
3. NH4Cl
4. HClO4
Молекулярное строение имеет
1. оксид кремния(IV)
2. нитрат бария
3. хлорид натрия
4. оксид углерода(II)
Из перечисленных веществ выберите три вещества, которые являются кислыми солями.
1. NaHCO3
2. HCOOK
3. (NH4)2SO4
4. KHSO3
5. Na2HPO4
6. Na3PO4
Верны ли следующие суждения о свойствах железа?
А. Железо реагирует с разбавленной азотной кислотой.
Б. В холодной концентрированной серной кислоте железо пассивируется.
1. верно только А
2. верно только Б
3. верны оба суждения
4. оба суждения неверны
Какой из перечисленных оксидов реагирует с раствором соляной кислоты, но не реагирует с раствором гидроксида натрия?
1. CO
2. SO3
3. ZnO
4. MgO
Гидроксид алюминия реагирует с каждым из двух веществ:
1. KOH и Na2SO4
2. HCl и NaOH
3. CuO и KNO3
4. Fe2O3 и HNO3
Карбонат бария реагирует с раствором каждого из двух веществ:
1. H2SO4 и NaOH
2. NaCl и CuSO4
3. HCl и CH3COOH
4. NaHCO3 и HNO3
В схеме превращений
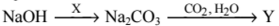
веществами X и Y являются:
1. K2CO3
2. MgCO3
3. NaHCO3
4. CO2
5. CO
Бутен-1 является структурным изомером
1. бутана
2. циклобутана
3. бутина-2
4. бутадиена
В отличие от пропана, циклопропан вступает в реакцию
1. дегидрирования
2. гидрирования
3. горения
4. этерификации
Свежеосаждённый гидроксид меди(II) реагирует с
1. пропанолом-1
2. глицерином
3. этиловым спиртом
4. диэтиловым эфиром
Формальдегид не реагирует с
1. Ag2O (NH3 р-р)
2. O2
3. H2
4. СН3ОСН3
Бутанол-1 образуется в результате взаимодействия
1. бутаналя с водой
2. бутена-1 с водным раствором щёлочи
3. 1-хлорбутана с водным раствором щёлочи
4. 1,2-дихлорбутана с водой
Метиламин взаимодействует с
1. пропаном
2. хлорметаном
3. водородом
4. гидроксидом натрия
В схеме превращений
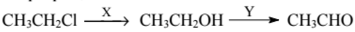
веществами X и Y являются:
1. H2
2. CuO
3. Cu(OH)2
4. NaOH (H2O)
5. NaOH (спирт)
К реакциям обмена относят
1. дегидрирование спиртов
2. галогенирование алканов
3. реакцию щелочных металлов с водой
4. реакцию нейтрализации
Скорость реакции азота с водородом уменьшится при
1. понижении температуры
2. увеличении концентрации азота
3. использовании катализатора
4. повышении давления в системе
Сокращённому ионному уравнению соответствует взаимодействие
H+ + OH- = H2O
1. H2SO4 и NaOH
2. Cu(OH)2 и HCl
3. NH4Cl и KOH
4. HCl и HNO3
Водород образует взрывчатую смесь с
1. кислородом
2. метаном
3. сероводородом
4. углекислым газом
Верны ли следующие суждения о природном газе?
А. Основными составляющими природного газа являются метан и ближайшие его гомологи.
Б. Природный газ служит сырьём для получения ацетилена.
1. верно только А
2. верно только Б
3. верны оба суждения
4. оба суждения неверны
Вычислите массу нитрата калия (в граммах), которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%.
Ответ:___________________ г (Запишите число с точностью до десятых.)
В результате реакции, термохимическое уравнение которой
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах).
Ответ:___________________г (Запишите число с точностью до целых.)
Вычислите массу кислорода (в граммах), необходимого для полного сжигания 6,72 л (н.у.) сероводорода.
Ответ:___________________г (Запишите число с точностью до десятых.)
В заданиях 27–35 к каждому элементу подберите соответствующий элемент и запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться.
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) бутин
Б) циклогексан
В) пропан
Г) бутадиен
ОБЩАЯ ФОРМУЛА
1) CnH2n+2
2) CnH2n
3) CnH2n–2
4) CnH2n–4
5) CnH2n–6
Установите соответствие между уравнением реакции и свойством элемента азота, которое он проявляет в этой реакции.
УРАВНЕНИЕ РЕАКЦИИ
А) NH4HCO3 = NH3 + H2O + CO2
Б) 3СuO + 2NH3 = N2 + 3Cu + 3H2O
В) 4NH3 + 5O2 = 4NО + 6H2O
Г) 6Li + N2 = 2Li3N
СВОЙСТВО АЗОТА
1) является окислителем
2) является восстановителем
3) является и окислителем, и восстановителем
4) не проявляет окислительно-восстановительных свойств
Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора.
ФОРМУЛА СОЛИ
А) CuCl2
Б) AgNO3
В) K2S
Г) NaBr
ПРОДУКТ
1) водород
2) кислород
3) металл
4) галоген
5) сера
6) азот
Установите соответствие между названием соли и её отношением к гидролизу.
НАЗВАНИЕ СОЛИ
А) хлорид аммония
Б) сульфат калия
В) карбонат натрия
Г) сульфид алюминия
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизу не подвергается
4) гидролизуется по катиону и аниону
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе.
УРАВНЕНИЕ РЕАКЦИИ
А) N2(г) + 3H2(г)  2NH3(г)
2NH3(г)
Б) 2Н2(г) + О2(г)  2Н2О(г)
2Н2О(г)
В) H2(г) + Cl2(г)  2НCl(г)
2НCl(г)
Г) SO2(г) + Cl2(г)  SO2Cl2(г)
SO2Cl2(г)
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) смещается в сторону продуктов реакции
2) смещается в сторону исходных веществ
3) не происходит смещения равновесия
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать.
ФОРМУЛА ВЕЩЕСТВА
А) S
Б) SO3
В) Zn(OH)2
Г) ZnBr2
РЕАГЕНТЫ
1) AgNO3, Na3PO4, Cl2
2) BaO, H2O,
3) H2, Cl2, O2
4) HBr, LiOH, CH3COOH
5) H3PO4, BaCl2, CuO
Установите соответствие между формулами веществ и реагентом, с помощью которого их можно различить.
ФОРМУЛЫ ВЕЩЕСТВ
А) NH3(р-р) и H2O
Б) KCl и NaОН
В) NaCl и CaCl2
Г) FeCl3 и MgCl2
РЕАГЕНТ
1) HCl
2) KI
3) HNO3
4) KNO3
5) CuSO4
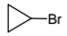
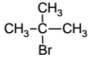
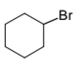
Установите соответствие между исходными веществами и продуктами, которые преимущественно образуются при их взаимодействии с бромом.
НАЗВАНИЕ ВЕЩЕСТВА
А) этан
Б) изобутан
В) циклопропан
Г) циклогексан
ПРОДУКТ БРОМИРОВАНИЯ
1) 
2) 
3) 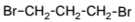
4) 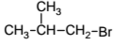
5) 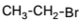
6) 
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) уксусная кислота и карбонат натрия
Б) муравьиная кислота и гидроксид натрия
В) муравьиная кислота и гидроксид меди(II) (при нагревании)
Г) этанол и натрий
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) пропионат натрия
2) этилат натрия
3) формиат меди(II)
4) формиат натрия
5) ацетат меди(II)
6) углекислый газ
Часть 2.
Запишите сначала номер задания (36, 37 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
Na2SO3 + ... + KOH → K2MnO4 + ... + H2O
Определите окислитель и восстановитель.
Элементы ответа:
1) составлен электронный баланс:
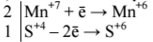
2) указано, что сера в степени окисления +4 является восстановителем, а марганец в степени окисления +7 (или перманганат калия за счёт марганца в степени окисления +7) – окислителем;
3) определены недостающие вещества, и составлено уравнение реакции:
Na2SO3 + 2KMnO4 + 2KOH = Na2SO4 + 2K2MnO4 + H2O
Железо растворили в горячей концентрированной серной кислоте. Полученную соль обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество нагрели с железом.
Напишите уравнения четырёх описанных реакций.
Элементы ответа.
Написаны четыре уравнения описанных реакций:
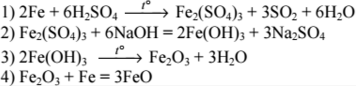
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
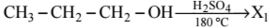 →
→ 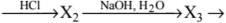
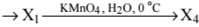
При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ включает в себя пять уравнений реакций, соответствующих схеме превращений:
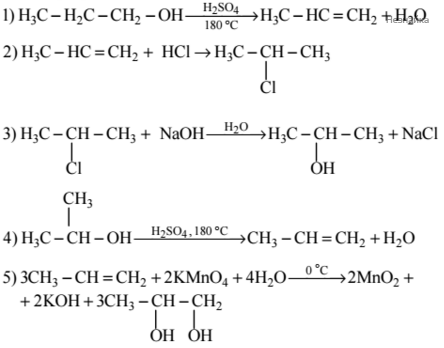
Определите массовые доли (в %) сульфата железа(II) и сульфида алюминия смеси, если при обработке 25 г этой смеси водой выделился газ, который полностью прореагировал с 960 г 5%-ного раствора сульфата меди. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Элементы ответа.
1. Составлены уравнения реакций:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
CuSO4 + H2S = CuS + H2SO4
2. Рассчитано количество вещества сероводорода:
n(CuSO4) = 960 x 0,05 / 160 = 0,3 моль
n(H2S) = n(CuSO4) = 0,3 моль
3. Рассчитаны количество вещества и массы сульфида алюминия и сульфата железа (II):
n(Al2S3) = 1/3n (H2S) = 0,1 моль
m(Al2S3) = 0,1 x 150 = 15 г
m(FeSO4) = 25 - 15 = 10 г
4. Определены массовые доли сульфата железа(II) и сульфида алюминия в исходной смеси:
ω(FeSO4) = 10 / 25 = 0,4, или 40%
ω(Al2S3) = 15 / 25 = 0,6, или 60%
При сжигании образца некоторого органического соединения массой 14,8 г получено 35,2 г углекислого газа и 18,0 г воды.
Известно, что относительная плотность паров этого вещества по водороду равна 37. В ходе исследования химических свойств этого вещества установлено, что при взаимодействии этого вещества с оксидом меди(II) образуется кетон.
На основании данных условия задания:
1. произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2. запишите молекулярную формулу исходного органического вещества;
3. составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4. напишите уравнение реакции этого вещества с оксидом меди(II).
Элементы ответа.
1. Найдено количество вещества продуктов сгорания:
Общая формула вещества – CxHyOz
n(CO2) = 35,2 / 44 = 0,8 моль; n(С) = 0,8 моль
n(H2O) = 18,0 / 18 = 1,0 моль; n(H) = 1,0 · 2 = 2,0 моль
m(O) = 14,8 – 0,8 · 12 – 2 = 3,2 г; n(O) = 3,2 ⁄ 16 = 0,2 моль
2. Определена молекулярная формула вещества:
x : y : z = 0,8 : 2 : 0,2 = 4 : 10 : 1
Вычисленная формула – C4H10O
Mвыч(C4H10O) = 74 г/моль
Mист(CxHyOz) = 37 · 2 = 74 г/моль
Молекулярная формула исходного вещества – C4H10O
3. Составлена структурная формула вещества:
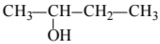
4. Записано уравнение реакции вещества с оксидом меди(II):
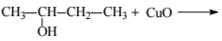
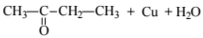
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||