Вариант 30
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне один неспаренный электрон. Запишите в поле ответа номера выбранных элементов.
1. Mg
2. Si
3. H
4. Cl
5. Se
Из указанных в ряду химических элементов выберите три p-элемента. Расположите выбранные элементы в порядке уменьшения валентности в их летучих водородных соединениях.
1) Cl
2) Sr
3) Se
4) P
5) K
Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в оксидах может принимать значение +2.
1) Cr
2) Na
3) P
4) As
5) N
Из предложенного перечня выберите два вещества с высокой температурой плавления, которые содержат ковалентную полярную связь.
1) Гидроксид натрия
2) Кремнезем
3) Алмаз
4) Серная кислота
5) Хлорид кальция
Среди предложенных названий и формул веществ, расположенных в пронумерованных ячейках, выберите названия или формулы: А) нерастворимого основания, Б) средней соли, В) двухосновной кислоты
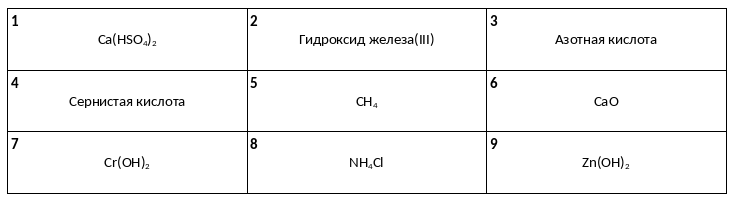
Даны две пробирки с раствором вещества X. В одну из них добавили раствор хлорида алюминия, при этом наблюдали образование белого осадка. В другую пробирку прилили раствор вещества Y. При этом произошла химическая реакция, которая не сопровождалась видимыми признаками. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) Sr(OH)2
2) NH3
3) H2SO4
4) K2CO3
5) AgF
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Na2SiO3
Б) FeCl3
В) HCl
Г) CuO
РЕАГЕНТЫ
1) NH3 (г), CO, HBr
2) NaOH, Br2, ZnO
3) LiOH, KOH, NaHCO3 (p-p)
4) LiNO3, KMnO4, AgNO3
5) CaBr2, CO2 (p-p), HNO3
Установите соответствие между формулой вещества и формулами реагентов, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Fe
Б) KI
В) CO2
Г) HBr
ФОРМУЛЫ РЕАГЕНТОВ
1) NaOH, С, Mg
2) Cl2, Fe(NO3)3, AgNO3
3) Cl2, NaOH, КНСО3
4) Na2SO4, НСl, FeCl3
5) NaOH, C, O2
Задана следующая схема превращений:
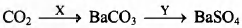
Определите, какие из указанных веществ являются веществами X и Y.
1) Ва
2) Ва(ОН)2
3) Н2O
4) НСl
5) H2SO4
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) С6Н5С(O)СН3
Б) С6Н5СН2ОСН2С6Н5
В) С6Н5СН2ОН
КЛАСС ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1) простые эфиры
2) фенолы
3) спирты
4) кетоны
Из предложенного перечня выберите два вещества, которые являются структурными изомерами 2-метилбутадиена-1,3.
1) пентин-1
2) метилциклобутан
3) циклопентен
4) 2-метилбутен-1
5) метилциклопентан
Из предложенного перечня выберите все углеводороды, при гидратации которых образуется кетон.
1) этен
2) этин
3) бутен-1
4) бутин-2
5) пропин
Из предложенного перечня выберите два вещества, с которыми реагирует пропиламин.
1) хлорметан
2) хлороводород
3) водород
4) фосфор
5) гидроксид алюминия
Установите соответствие между названием вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с эквимольным количеством бромоводорода: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) циклопропан
Б) пропен (в присутствии органических перекисей)
В) стирол
Г) бутин-2
ПРОДУКТ РЕАКЦИИ
1) 1-бромпропан
2) 2-бромпропан
3) 2-бромбутен-2
4) 2-бромпропен
5) 2-бром-2-фенилэтан
6) 1-бром-1-фенилэтан
Установите соответствие между реагирующими веществами и органическим веществом, которое является продуктом взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) фенол и гидроксид калия
Б) фенол и калий
В) фенолят калия и углекислый газ
Г) фенолят калия и бромметан
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) трибромфенол
2) фенолят калия
3) фенол
4) метилфениловый эфир
5) монобромфенол
6) бензоат натрия
Задана следующая схема превращений:
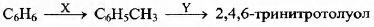
Определите, какие из указанных веществ являются веществами Х и Y.
1) СН4
2) СН3Сl
3) CH3NH2
4) NO2
5) HNO3
Уравнение C2H6 (г) + Cl2 (г) → C2H5Cl + HCl соответствует реакции (выберите все верные варианты)
1. Присоединения
2. Замещения
3. Обмена
4. Обратимой
5. Гомогенной
Из предложенного перечня выберите все воздействия, которые позволят ускорить гидрирование этаналя в газовой фазе:
1. Повышение площади поверхности соприкосновения реагентов
2. Понижение температуры
3. Введение ингибитора
4. Повышение давления
5. Повышение концентрации этанола
Установите соответствие между схемой реакции и изменением степени окисления фосфора в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) KH2PO2 + H2O + Cl2 → HCl + KH2PO4
Б) Ca3P2 + O2 → Ca3(PO4)2
В) Ca3(PO4)2 + SiO2 + C → CaSiO3 + CO + P4
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ФОСФОРА
1) P+3 → P+5
2) P+5 → P0
3) P–3 → P+5
4) P+1 → P+5
5) P+4 → P0
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) СuВr2
Б) HNO3
В) NaOH
Г) Al2(SO4)3
ПРОДУКТ ЭЛЕКТРОЛИЗА
1) водород, алюминий
2) водород, кислород
3) натрий, кислород
4) медь, бром
5) медь и водород
6) натрий и водород

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке возрастания значения pH их водных растворов.
1) Cr(NO3)3
2) Ca(OH)2
3) CH3COONH4
4) HClO4
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) СаСO3(тв.) [math]\leftrightarrows[/math] СаО(тв) + СO2(г) - Q
Б) СО(г) + С12(г) [math]\leftrightarrows[/math] СОСl2(г)+ Q
В) N2(г) + ЗН2(г) [math]\leftrightarrows[/math] 2NH3(г) + Q
Г) С(тв.) + С02(г) [math]\leftrightarrows[/math] 2СО(г) + Q
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили вещества А и B. При этом исходная концентрация вещества B составляла 0,9 моль/л. В результате протекания обратимой реакции A (тв.) + 3B (г.) ⇋ C (г.) + 2D (г.) В реакционной системе установилось химическое равновесие, при котором концентрация вещества D составила 0,4 моль/л. Определите равновесные концентрации веществ B (X) и C (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Установите соответствие между названиями веществ и реагентом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВА
А) бутин-1 и бутин-2
Б) этан и пропен
В) этанол и глицерин
Г) фенол и 2,4,6-тринитрофенол
РЕАГЕНТ
1) Cu(OH)2
2) Br2
3) HNO2
4) Ag2O (NH3)
5) фенолфталеин
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) стирол
Б) пропен
В) бутан
Г) метан
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) синтез ацетилена
2) производство полистирола
3) производство этанола
4) получение уксусной кислоты
5) производство полипропилена
Сколько граммов воды нужно испарить из 500 г 10%-ного раствора гидроксида натрия, чтобы увеличить его массовую долю в 1,5 раза?
Ответ:_______________________г.
(Запишите число с точностью до целых.)
Чему равна масса соединения, образовавшегося в результате сгорания в избытке кислорода 18,4 г металлического натрия?
Ответ:_______________________г.
(Запишите число с точностью до десятых.)
Определите массу меди (кг), которую можно получить при восстановлении алюминием образца оксида меди(II) массой 312,5 кг, если в указанном образце содержится 4% примеси оксида железа(III). (Запишите число с точностью до целых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Гидрофосфат натрия, хлор, гидроксид кальция, азотная кислота, иод, бромид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется две кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl
2) Указан электронный баланс
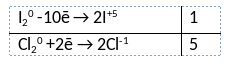
3) Указано, что хлор в степени окисления 0 является окислителем, а иод в степени окисления 0 является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции образуется осадок. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
6Na2HPO4 + 3Ca(OH)2 = Ca3(PO4)2 + 4Na3PO4 + 6H2O
2) Написано полное ионное уравнение:
12Na+ + 6HPO42- + 3Ca2+ + 6OH- = Ca3(PO4)2 + 12Na+ + 4PO43- + 6H2O
3) Написано сокращённое ионное уравнение:
6HPO42- + 3Ca2+ + 6OH- = Ca3(PO4)2 + 4PO43- + 6H2O
Натрий прореагировал с водородом. Продукт реакции растворили в воде, при этом образовался газ, реагирующий с хлором, а полученный раствор при нагревании прореагировал с хлором с образованием смеси двух солей. Напишите уравнения описанных реакций.
1) 2Na + H2= 2NaH
2) NaH + H2O = NaOH + H2↑
3) H2 + Cl2 = 2HCl
4) 6NaOH + 3Cl2 = 5 NaCl + NaClO3 + 3H2O
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
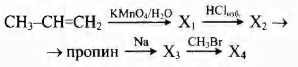
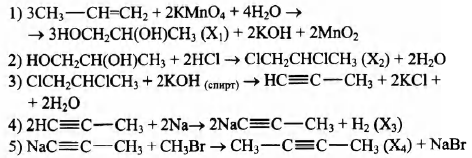
При сплавлении 16,4 г натриевой соли предельной одноосновной карбоновой кислоты с избытком едкого натра выделилось 4,48 л газа (н. у.).
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции соли с бромметаном.
2) C2H3NaO2;
3) CH3C(O)ONa;
4) CH3C(O)ONa + CH3Br → CH3C(O)OCH3 + NaBr
Смесь, содержащую оксид фосфора (V) и оксид калия, в которой соотношение числа атомов кислорода к числу атомов фосфора равно 14,5 : 4, сплавили, затем растворили в горячей воде. В результате получили 447,4 г раствора, в котором массовая доля атомов водорода составляет 7,6%. Вычислите массу фосфата калия в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Элементы ответа:
Записаны уравнения реакций:
(1) 3K2O + P2O5 = 2K3PO4
(2) 3H2O + P2O5 = 2H3PO4
(3) 2K3PO4 + H3PO4 = 3K2HPO4
Рассчитаны количество вещества реагентов и масса продуктов реакций:
m(H) = 447,4 • 0,076 = 34 г
n(H) = 34 моль
n(H2O) = 0,5n(H) = 17 моль
m(H2O) = 17 • 18 = 306 г
m(сплава) = 447,4 − 306 = 141,4 г
Пусть взяли x моль K2O, y моль P2O5, тогда
m(смеси) = 94x + 142y = 141,4 г
(x + 5y) : 2y = 14,5 : 4
x = 0,9 моль; y = 0,4 моль
P2O5 — избыток
n(P2O5 прореагировало (1)) = 0,3 моль
n(P2O5 избыток) = 0,1 моль
n(H3PO4) = 0,2 моль
n(K3PO4 (1)) = 0,6 моль
n(K3PO4 прореагировало) = 0,4 моль
n(K3PO4 осталось) = 0,2 моль
m(K3PO4 осталось) = 0,2 • 212 = 42,4 г
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||