Вариант 28
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне три неспаренных электрона. Запишите в поле ответа номера выбранных элементов.
1. Ti
2. Sb
3. B
4. O
5. N
Из указанных в ряду элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке увеличения валентности в их летучих водородных соединениях.
1) Be
2) O
3) Cl
4) Mn
5) N
Из числа указанных в ряду элементов выберите два элемента, которые в высших оксидах проявляют одинаковую степень окисления.
1) С
2) Mg
3) Mn
4) P
5) Cl
Из предложенного перечня выберите два вещества, которые имеют кристаллическую структуру, сходную со структурой алмаза.
1) Si
2) NaCl
3) Mn
4) SiC
5) CO2
Среди предложенных названий и формул веществ, расположенных в пронумерованных ячейках, выберите названия или формулы: А) амфотерного гидроксида, Б) средней соли, В) двухосновной кислоты.
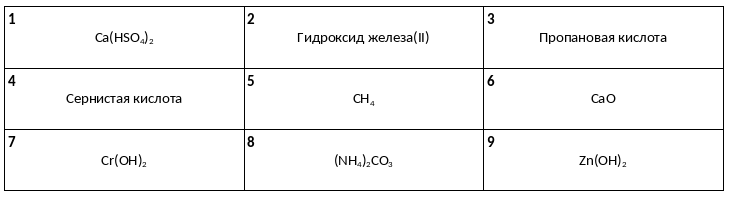
К одной из двух пробирок с раствором сульфата хрома (III) добавили раствор гидроксида X, а через другую пропустили газ Y. В результате в каждой из пробирок наблюдалось выпадение серо-зеленого осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) NH3
2) CO2
3) H2S
4) Cu(OH)2
5) RbOH
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) CaCO3
Б) KOH
В) Na2SiO3
Г) SiO2
РЕАГЕНТЫ
1) K2SO4, AgNO3, AlCl3 (p-p)
2) SrCl2, Fe(NO3)3, NaOH
3) CO2 (p-p), HCl, HNO3
4) Li2CO3, NaOH, HF
5) Br2, O2, Н2
Установите соответствие между формулой вещества и формулами реагентов, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) NaOH
Б) NO2
В) H3PO4
Г) Al2O3
ФОРМУЛЫ РЕАГЕНТОВ
1) AgNO3, MgCl2, LiOH
2) НВг, NaOH, К2O
3) AgNO3, Pb(NO3)2, H3PO4
4) S, ZnO, FeCl2
5) NaOH, Cu, H2O
Задана следующая схема превращений:
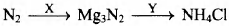
Определите, какие из указанных веществ являются веществами X и Y.
1) Mg
2) СаО
3) Н2O
4) НСl
5) NH3
Установите соответствие между названием вещества и общей формулой класса/группы, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) пропан
Б) бутен-2
В) пропин
ОБЩАЯ ФОРМУЛА
1) CnH2n+2
2) CnH2n
3) CnH2n-2
4) CnH2n-4
Из предложенного перечня выберите два вещества, которые являются структурными изомерами пентина-2.
1) пентин-1
2) метилциклобутан
3) циклопентен
4) 2-метилбутен-2
5) метилциклопентан
Из предложенного перечня выберите все вещества, с которыми реагируют и бутин-2, и ацетилен.
1) NaH
2) H2O (Hg2+)
3) KMnO4 (H+)
4) Ag2O (NH3)
5) NaOH
Из предложенного перечня выберите два вещества, с которыми реагирует диметиламин.
1) пропан
2) азотистая кислота
3) азот
4) хлороводород
5) хром
Установите соответствие между названием вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с эквимольным количеством бромоводорода: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) 2-метил пропен
Б) пропен (в присутствии органических перекисей)
В) пропен
Г) бутин-2
ПРОДУКТ РЕАКЦИИ
1) 1 -бромпропан
2) 2-бромпропан
3) 2-бромбутен-2
4) 2-бромпропен
5) 2-бром-2-метилпропан
6) 1-бром-2-метилпропан
Установите соответствие между реагирующими веществами и органическим веществом, которое является продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) этанол и калий
Б) пропанол-2 и бромоводород
В) пропанол-1 и бромоводород
Г) муравьиная кислота и метанол
ПРОДУКТ РЕАКЦИИ
1) этилат калия
2) 1-бромпропан
3) 2-бромпропан
4) мет ил ацетат
5) метил формиат
6) метилэтиловый эфир
Задана следующая схема превращений веществ:
НС(O)OН —X→ НС(O)OСН3 —Y→ СН3ОН
Определите, какие из указанных веществ являются веществами Х и Y.
1. CH4
2. CH3Cl
3. CH3OH
4. CO2
5. KOH
Выберите все вещества, которые вступают с бромом в реакцию замещения
1. Водород
2. Натрий
3. Бутан
4. Бромид железа (II)
5. Иодоводород
Из предложенного перечня реакций выберите все факторы, под действием которых увеличится скорость реакции алюминия с раствором едкого натра:
1. Понижение давления
2. Повышение концентрации гидроксида натрия
3. Повышение давления
4. Увеличение площади поверхности соприкосновения веществ
5. Повышение температуры
Установите соответствие между схемой реакции и элементом, который в данной реакции является восстановителем: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) Si + KOH + H2O → K2SiO3 + H2
Б) SiC + O2 → SiO2 + CO2
В) Ca3(PO4)2 + SiO2 + C → CaSiO3 + P + CO
ВОССТАНОВИТЕЛЬ
1) P
2) Si
3) H
4) C
5) O
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) CuCl2
Б) Hg(NO3)2
В) CrCl3
Г) MgSO4
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) медь, хлор
2) водород, кислород
3) хром,водород, хлор
4) магний, водород, кислород
5) ртуть, кислород

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке возрастания значения pH их водных растворов.
1) NaClO3
2) KClO
3) (NH4)2SO4
4) HI
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ
A) СаСO3(тв.) [math]\leftrightarrows[/math] СаО(тв.) + СO2(г)
Б) 2SO3(г) [math]\leftrightarrows[/math]2SO2(r) + O2(r)
B) С(тв.) + СO2(г) [math]\leftrightarrows[/math] 2СО(г)
Г) СО(г) + Сl2(г) [math]\leftrightarrows[/math] СОСl2(г)
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили некоторое количество серы и водяного пара. При этом исходная концентрация водяного пара составляла 0,8 моль/л. В результате протекания обратимой реакции 3S (ж.) + 2H2O (г.) ⇋ 2H2S (г.) + SO2 (г.) в реакционной системе установилось химическое равновесие, при котором концентрация сероводорода составила 0,6 моль/л. Определите равновесные концентрации H2O (X) и SO2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить их водные растворы: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛЫ ВЕЩЕСТВ
А) фенол (р-р) и пентанол-1
Б) пропанол-1 и глицерин
В) муравьиная кислота и пропионовая кислота
Г) пальмитиновая кислота и олеиновая кислота
РЕАГЕНТ
1) Вг2(водн.)
2) Cu(OH)2
3) Na
4) H2SO4
5) NH3
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) изопрен
Б) пропен
В) этен
Г) метан
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) синтез ацетилена
2) производство каучука
3) производство этанола
4) получение хлорвинила
5) производство полипропилена
Определите массу воды, которую нужно добавить к 50 г 20%-ной раствора соляной кислоты, чтобы она стала 10%-ной.
Ответ:___________________г.
(Запишите число с точностью до целых).
Чему равен объем азота, который при н.у. необходимо взять для получения 17 г аммиака при условии количественного выхода?
Ответ:___________________л.
(Запишите число с точностью до десятых.)
Определите массу оксида цинка (г), который можно получить при обжиге 970 г содержащего ZnS минерала сфалерита, если известно, что массовая доля примесей в сфалерите составляет 10%. (Запишите число с точностью до целых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Пероксид натрия, иодид калия, силикат калия, нитрит калия, серная кислота (разбавл.), гидрокарбонат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции выделяется газ, образуется окрашенное простое вещество. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
2KI + 2KNO2 + 2H2SO4 = 2NO + I2 + 2K2SO4 + 2H2O
2) Указан электронный баланс
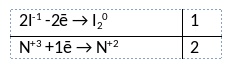
3) Указано, что азот в степени окисления +3 (нитрит калия) является окислителем, а иод в степени окисления -1 (иодид калия) является восстановителем.
Из предложенного перечня веществ выберите две соли, которые вступают между собой в реакцию ионного обмена. В ходе реакции образуется осадок. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
K2SiO3 + Ca(HCO3)2 = CaSiO3 + 2KHCO3
2) Написано полное ионное уравнение:
2K+ + SiO32- + Ca2+ + 2HCO3- = CaSiO3 + 2K+ + 2HCO3-
3) Написано сокращённое ионное уравнение:
SiO32- + Ca2+ = CaSiO3
Осадок, полученный при взаимодействии растворов сульфата алюминия и нитрата бария, отфильтровали. Фильтрат обработали едким натром в мольном соотношении 1:3. Выпавший осадок отделили и прокалили. Полученное вещество обработали избытком раствора соляной кислоты. Напишите уравнения описанных реакций.
1) Al2(SO4)3 + 3Ba(NO3)2 = 3BaSO4↓ + 2Al(NO3)3
2) Al(NO3)3 + 3NaOH = Al(OH)3↓ + 3NaNO3
3) 2Al(OH)3 = Al2O3 + 3H2O
4) Al2O3 + 6HCl = 2AlCl3 + 3H2O
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
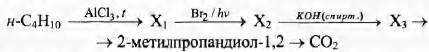
При написании уравнений реакций используйте структурные формулы органических веществ.
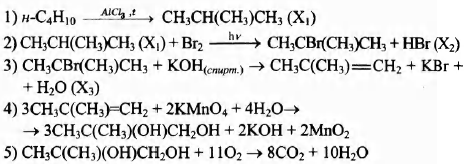
При сгорании в кислороде навески предельной карбоновой кислоты массой 6,0 г образовался углекислый газ объёмом 4,48 л. Установите формулу кислоты.
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле.
4) напишите уравнение реакции кислоты с гидрокарбонатом калия.
2) С2Н4O;
3) СН3СООН;
4) СН3СООН + КНСО3 → СН3СООК + СO2 + Н2O.
Кристаллогидрат сульфата алюминия, в котором массовая доля серы меньше массовой доли кислорода в 5 раз, растворили в воде с образованием раствора массой 722,4 г. Полученный раствор подвергли электролизу до выделения на аноде 35,84 л (н.у.) газа. К образовавшемуся раствору добавили 424 г 10 %-го раствора карбоната натрия, после всех реакций его массовая доля уменьшилась в 10 раз. Определите массу растворенного кристаллогидрата сульфата алюминия. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Элементы ответа:
Записаны уравнения реакций:
1) 2H2O = 2H2 + O2
2) Al2(SO4)3 + 3Na2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 3Na2SO4
Пусть формула кристаллогидрата сульфата алюминия имеет вид Al2(SO4)3 * xH2O
Пусть количество кристаллогидрата равно 1 моль, тогда:
n(S) = 3 моль
n(O) = 12 + x моль
Пользуясь условием об отношении массовых долей элементов получаем уравнение:
((12 + x) моль * 16 г/моль) / (3 моль * 32 г/моль) = 5
Решая это уравнение, получаем, что х = 18 моль. Следовательно, кристаллогидрат сульфата алюминия выглядит следующим образом: Al2(SO4)3 * 18H2O
При электролизе сульфата алюминия происходит электролиз воды:
n(O2) = 35,84 л / 22,4 л/моль = 1,6 моль
n(H2O) = 2n(O2) = 3,2 моль
Найдем массу раствора после реакции:
mр-ра = 722,4 г - 18 г/моль * 3,2 моль = 664,8 г
Найдем количество вещества карбоната натрия:
n(Na2CO3) = (424 г * 0,1) / 106 г/моль = 0,4 моль
По условию задачи, карбонат натрия остался в растворе после завершения реакции, из чего можно сделать вывод,
что в недостатке находился сульфат алюминия. Пусть его в растворе было z моль. Тогда прореагировало 3z моль карбоната натрия, образовалось 2z моль гидроксида алюминия и 3z моль оксида углерода (IV).Найдем конечную массу раствора:
mр-ра кон = 664,8 г + 424 г - 2z моль * 78 г/моль - 3z моль * 44 г/моль = 1088,8 - 288z г
nост(Na2CO3) = 0,4 - 3z моль
mост(Na2CO3) = (0,4 - 3z) моль * 106 г/моль = 42,4 - 318z г
По условию задачи, массовая доля карбоната натрия в конечном растворе составляет 1%:
w(Na2CO3) = (42,4 - 318z) г / (1088,8 - 288z) г = 0,01
Решая данное уравнение, находим, что z = 0,1 моль
Зная количество сульфата алюминия, можем вычислить массу кристаллогидрата:
m(Al2(SO4)3 * 18H2O) = 0,1 моль * 666 г/моль = 66,6 г
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||