Вариант 27
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне два электрона. Запишите в поле ответа номера выбранных элементов.
1. B
2. Mg
3. P
4. Si
5. He
Из указанных в ряду химических элементов выберите три элемента, которые образуют летучие водородные соединения. Расположите выбранные элементы в порядке увеличения валентности в их летучих водородных соединениях.
1) Ne
2) Be
3) N
4) C
5) O
Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в оксидах может принимать значение +1.
1) N
2) C
3) B
4) Na
5) Al
Выберите два вещества, которые в твердом состоянии имеют такой же тип кристаллической решетки, что и иод.
1) кремний
2) бром
3) уксусная кислота
4) оксид кремния (IV)
5) сульфат меди (II)
Среди предложенных названий и формул веществ, расположенных в пронумерованных ячейках, выберите названия или формулы: А) основного оксида, Б) кислой соли, В) амфотерного гидроксида.
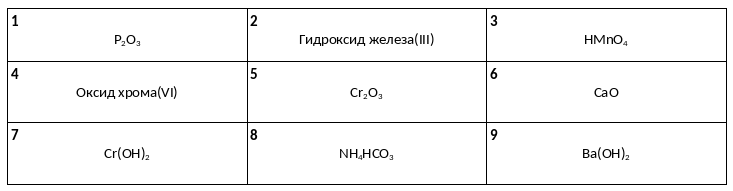
К одной из двух пробирок с раствором сульфата меди (II) добавили вещество Х, а к другой – вещество Y. В первой пробирке наблюдалось выпадение черного осадка, а во второй пробирке реакция протекала согласно ионному уравнению Cu2+ + 2OH– = Cu(OH)2 Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) NaI
2) Ba(OH)2
3) LiOH
4) K2S
5) K2CO3
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Ca(HCO3)2
Б) CO2
В) H2SO4 (конц.)
Г) SiO2
РЕАГЕНТЫ
1) C, Mg, NaOH
2) LiCl (p-p), Na2СO3, Fe(NO3)2
3) H2, KOH, Na2SO4
4) H2O, N2, Cl2O7
5) HCl (р-р), Ca(OH)2, Na3PO4
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Mg
Б) P2O5
В) Fe(OH)3
Г) MgBr2
РЕАГЕНТЫ
1) КОН, СН3СООН, НВг
2) СO2, Si, СН3СООН
3) Cl2, AgNO3, Ва(ОН)2
4) Н2O, NaOH, O2
5) KOH, MgO, H2O
Задана следующая схема превращений веществ:
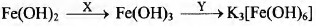 Определите, какие из указанных веществ являются веществами X и Y.
Определите, какие из указанных веществ являются веществами X и Y.
1. KCl
2. KOH
3. H2
4. H2O2
5. K2O
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) бензол
Б) глицерин
В) этин
КЛАСС/ГРУППА
1) альдегиды
2) спирты
3) аминокислоты
4) углеводороды
Из предложенного перечня веществ выберите два вещества, в которых все атомы углерода находятся в состоянии sp2-гибридизации.
1) этен
2) толуол
3) изопрен
4) дивинил
5) этилацетат
Из предложенного перечня выберите все вещества, которые реагируют с водородом.
1) циклопропан
2) циклогексан
3) изобутан
4) изопрен
5) толуол
Из предложенного перечня выберите два вещества, которые реагируют с анилином.
1) бром
2) гидроксид кальция
3) фруктоза
4) азотная кислота
5) ацетат натрия
Установите соответствие между названием вещества и названием продукта, который преимущественно образуется при взаимодействии этого вещества с избытком бромоводорода: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) пропен
Б) пропин
В) циклопропан
Г) бутен-1
ПРОДУКТ РЕАКЦИИ
1) 1-бромбутан
2) 2-бромбутан
3) 2-бромпропан
4) 1-бромпропан
5) 1,2 -дибромпропан
6) 2,2-дибромпропан
Установите соответствие между схемой реакции и веществом X, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) бутанол-2 —X→ бутен-2
Б) бутанол-2 —X→ 2-бромбутан
В) бутанол-2 —X→ бутанон
Г) бутанол-1 —X→ бутаналь
ВЕЩЕСТВО X
1) бром
2) H2SO4(конц.)
3) вода
4) СuО (t)
5) NaBr
6) бромоводород
Задана следующая схема превращений веществ:
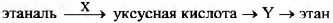
Определите, какие из указанных веществ являются веществами X и Y.
1) С2Н5ОН
2) СН3СООК
3) С2Н5Сl
4) Сu(ОН)2
5) H2SO4(t°)
Из предложенного перечня веществ выберите все вещества, взаимодействие которых с натрием является реакцией замещения.
1. ацетилен
2. фосфор
3. кислород
4. бромоводород
5. этанол
Из предложенного перечня выберите все условия, при которых будет наибольшей скорость реакции, протекающей по схеме:
Fe + кислота → соль + H2.
1. Проведение реакции с 15%-ной уксусной кислотой
2. Проведение реакции с 15%-ной соляной кислотой
3. Нагревание реакционной смеси
4. Использование порошка железа
5. Использование гранул железа
Установите соответствие между схемой реакции и схемой изменения степени окисления окислителя в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) N2O + NH3 → N2 + H2O
Б) NH3 + Cl2 → N2 + NH4Cl
В) NH2OH + H2O2 → N2 + H2O
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
1) –1 → –2
2) –1 → 0
3) –3 → 0
4) +1 → 0
5) 0 → –1
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) KNO3
Б) MgBr2
В) CuCl2
Г) AgNO3
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) металл и азот
2) водород и галоген
3) металл и галоген
4) металл и кислород
5) водород и кислород

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке убывания значения pH их водных растворов.
1) CH3NH2
2) KClO4
3) Al(NO3)3
4) Ba(OH)2
Установите соответствие между способом воздействия на равновесную систему СОСl2(г) [math]\leftrightarrows[/math] СО(г) + Сl2(г) - Q и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
ВОЗДЕЙСТВИЕ НА СИСТЕМУ
А) увеличение концентрации оксида углерода(II)
Б) уменьшение концентрации хлора
В) уменьшение давления
Г) увеличение температуры
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили S2Cl2 и водород. При этом исходная концентрация S2Cl2 составляла 0,4 моль/л. В результате протекания обратимой реакции S2Cl2 (г.) + H2 (г.) ⇋ 2HCl (г.) + 2S (ж.) в реакционной системе установилось химическое равновесие, при котором концентрации S2Cl2 и водорода составили 0,2 моль/л и 0,3 моль/л соответственно. Определите исходную концентрацию H2 (X) и равновесную концентрацию HCl (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Установите соответствие между формулами веществ и реагентом, с помощью которого их можно различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛЫ ВЕЩЕСТВ
А) K3PO4 и K2SO4
Б) K2SO4 и K2SO3
В) АlСl3 и ZnCl2
Г) Н3РO4 и НNO3
РЕАГЕНТ
1) H2O
2) NH3 • H2O
3) H2SO4
4) AgNO3
5) Cu
Установите соответствие между названием химического продукта и способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ПРОДУКТА
А) чугун
Б) метан
В) фенол
Г) лигроин
СПОСОБ ПОЛУЧЕНИЯ
1) выплавка в конвертере
2) выделение из каменноугольной смолы
3) выделение из природного газа
4) выплавка в доменной печи
5) перегонка нефти
Смешали 250 г раствора поваренной соли с массовой долей 15% и 30 г раствора с массовой долей 20%. Определите массовую долю соли в полученном растворе.
Ответ:___________________%.
(Запишите число с точностью до десятых.)
В результате реакции, термохимическое уравнение которой
2Н2(г) + O2(г) = 2Н2O(г) + 484 кДж,
выделилось 1452 кДж теплоты. Вычислите массу (в граммах) израсходованного при этом кислорода.
Ответ:___________________г.
Определите объём (л) оксида серы(IV) (н.у.), который может быть получен из 12 кг пирита с содержанием основного вещества 90%. (Запишите число с точностью до целых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Серная кислота, дихромат калия, сульфид меди(II), фосфин, гидроксид бария, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется раствор, содержащий только кислоту, выделяется бесцветный газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
PH3 + 4H2SO4 = H3PO4 + 4SO2 + 4H2O
2) Указан электронный баланс
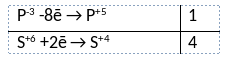
3) Указано, что сера в степени окисления +6 (серная кислота) является окислителем, а фосфор в степени окисления -3 (фосфин) является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции образуется слабое основание. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
2CH3COONH4 + Ba(OH)2 = (CH3COO)2Ba + 2NH3∙H2O
2) Написано полное ионное уравнение:
2CH3COO- + 2NH4+ + Ba2+ + 2OH- = 2CH3COO- + Ba+ + 2NH3∙H2O
3) Написано сокращённое ионное уравнение:
NH4+ + OH- = NH3∙H2O
Железо растворили в концентрированной азотной кислоте при нагревании. Полученную соль выделили и прокалили. Получившийся бурый порошок нагрели в атмосфере газа, выделившегося при растворении гидрида натрия в воде. Образовавшееся при этом вещество не притягивается магнитом. Напишите уравнения четырёх описанных химических реакций.
1) Fe + 6HNO3(конц.) = Fe(NO3)3 + 3NO2 + 3H2O
2) 4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2
3) NaH + H2O = NaOH + H2 ↑
4) Fe2O3 + H2 = 2FeO + H2O
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
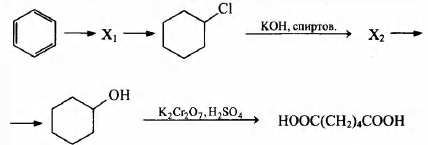
5) ЗС6Н11ОН + 4K2Cr2O7 + 16H2SO4 → 3HOOC—(CH2)4—COOH + 4Cr2(SO4)3 + 4K2SO4 + 19H2O
При сгорании 4,05 г органического вещества нециклического строения получили 6,72 л (н.у.) углекислого газа и 4,05 г воды. Известно, что данное вещество не реагирует с аммиачным раствором оксида серебра, но способно к гидратации, причем 1 моль его в присутствии катализатора присоединяет только 1 моль воды.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу вещества;
3) составьте структурную формулу вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции гидратации этого органического вещества.
2) молекулярная формула вещества С4H6
3) структурная формула СН3—С[math]\equiv[/math]С—СН3
4) уравнение реакции
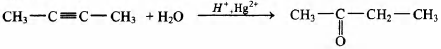
Раствор нитрата меди (II) массой 2 кг 730 г с массовой долей нитрата меди (II) 18,8%, содержащий в качестве примеси нитрат серебра, разлили на две колбы в соотношении 1 : 2. В первую колбу, содержащую меньшую часть раствора, опустили медную проволоку. После завершения реакции проволоку извлекли из раствора. При этом массовая доля нитрата меди (II) в первой колбе составила 20%. (Возможной реакцией меди с нитратом меди (II) пренебречь.) В раствор во второй колбе внесли порошок цинка, в результате получили бесцветный раствор.
Вычислите массовую долю соли в конечном растворе во второй колбе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Элементы ответа:
Записаны уравнения реакций:
(1) Cu + 2AgNO3 = 2Ag + Cu(NO3)2
(2) Zn + Cu(NO3)2 = Cu + Zn(NO3)2
(3) Zn + 2AgNO3 = 2Ag + Zn(NO3)2
Рассчитаны количество вещества реагентов и масса продуктов реакций:
m(р-ра в первой колбе) = 2730 / 3 = 910 г
m(Cu(NO3)2) = 0,188 • 910 = 171,08 г
n(Cu(NO3)2 [1]) = 171,08 / 188 = 0,91 моль
Пусть в растворе в первой колбе было
n(AgNO3) = х моль, тогда
прореагировало m(Cu) = 0,5 • х • 64 = 32х г
образовалось m(Cu(NO3)2) = 0,5 • х • 188 = 94х г
и выделилось m(Ag) = 108х г
ω(Cu(NO3)2) = (171,08 + 94х) / (910 + 32х − 108х) = 0,2
х = 0,1 моль
Тогда
m(р-ра во второй колбе) = 910 • 2 = 1820 г
n(Cu(NO3)2 [2]) = 0,91 • 2 = 1,82 моль
n(AgNO3 [3]) = 0,1 • 2 = 0,2 моль
n(Zn) = n(Cu(NO3)2 [2]) + 0,5n(AgNO3 [3]) = 1,82 + 0,1 = 1,92 моль
m(Zn) = 1,92 • 65 = 124,8 г
n(Zn(NO3)2) = 1,92 моль
m(Zn(NO3)2) = 189 • 1,92 = 362,88 г
n(Cu) = 1,82 моль
m(Cu) = 1,82 • 64 = 116,48 г
n(Ag) = 0,2 моль
m(Ag) = 0,2 • 108 = 21,6 г
m(конечного р-ра во второй колбе) = 1820 + 124,8 − 116,48 − 21,6 = 1806,72 г
ω(Zn(NO3)2) = 362,88 / 1806,72 = 0,201, или 20,1%
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||