Вариант 26
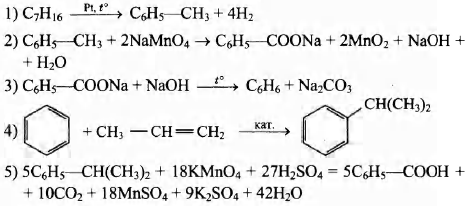
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне два неспаренных электрона. Запишите в поле ответа номера выбранных элементов.
1. O
2. F
3. Si
4. Cl
5. Br
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите выбранные элементы в порядке увеличения их металлических свойств.
1) Na
2) N
3) P
4) Li
5) Cs
Из указанных в ряду элементов выберите два элемента, степень окисления которых в оксидах может принимать значение +4.
1) Zn
2) Si
3) Cu
4) S
5) P
Из предложенного перечня выберите два вещества, которые имеют высокую температуру плавления и хорошую растворимость в воде, а в твердом агрегатном состоянии не проводят электрический ток.
1) SiO2
2) NaCl
3) Cu
4) KOH
5) C2H5OH
Среди предложенных названий и формул веществ, расположенных в пронумерованных ячейках, выберите названия или формулы: А) одноосновной кислоты, Б) амфотерного гидроксида, В) щёлочи.
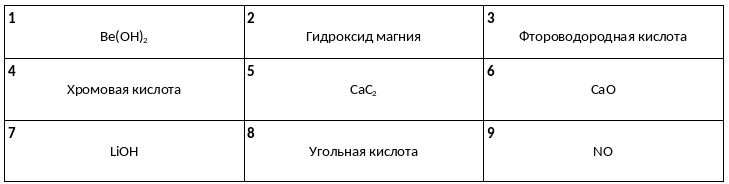
К одной из двух пробирок, содержащих раствор карбоната аммония, добавили раствор соли Х, а к другой – раствор вещества Y. В результате в первой пробирке наблюдалось выпадение осадка и выделение газа, а во второй – выделение газа, вызывающего помутнение известковой воды. Определите вещества X и Y, которые могут вступать в описанные реакции.
1) KOH
2) Ba(NO3)2
3) AlCl3
4) HCl
5) CaCl2
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) HNO3
Б) ZnO
В) K2SO3
Г) O2
РЕАГЕНТЫ
1) HNO3, H2SO4, KOH
2) KCl, NaHCO3, Ca
3) NO, H2, Na
4) FeCl3, Zn(NO3)2, HCl
5) Cu, Cu(OH)2, K2SiO3
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Li
Б) SiO2
В) Ca(OH)2
Г) CrCl3
РЕАГЕНТЫ
1) Mg, Са(ОН)2, Na2CO3
2) Na2O,H2O,Fe
3) H2SO4, Н2O, АlСl3
4) HCl,NH4Cl, Al
5) СаСO3, СН4, Mg
Задана следующая схема превращений веществ:
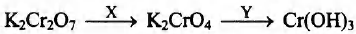
Определите, какие из указанных веществ являются веществами X и Y.
1. KCl (p-p)
2. KOH
3. Br2
4. H2SO4
5. H2S (p-p)
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) циклогексан
Б) лейцин
В) бутаналь
КЛАСС/ГРУППА
1) альдегиды
2) амины
3) аминокислоты
4) углеводороды
Из предложенного перечня веществ выберите два вещества, которые содержат атомы углерода как в состоянии sp2-, так и в состоянии sp3-гибридизации.
1. бутин-1
2. этилацетат
3. дивинил
4. пентен-2
5. стирол
Из предложенного перечня выберите все вещества, которые реагируют с водородом.
1) циклопропан
2) циклогексан
3) изобутан
4) стирол
5) бутан
Из предложенного перечня выберите два вещества, которые в реакции с диметиламином образуют соль.
1. хлороводород
2. гидроксид натрия
3. аммиачный раствор оксида серебра
4. азотная кислота
5. кислород
Установите соответствие между названием реакции и её преимущественным продуктом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ РЕАКЦИИ
А) дегидрирование пропана
Б) гидратация пропина
В) гидрирование пропена
Г) изомеризация бутана
ПРОДУКТ РЕАКЦИИ
1) 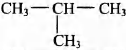
2) 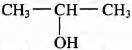
3) CH2 = CH — CH3
4) 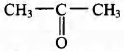
5) CH3 — CH2 — CH3
6) 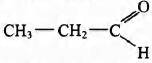
Установите соответствие между схемой реакции и органическим веществом, которое является продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) СН3—СВr3 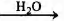
Б) (СН3СОО)2Са 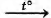
В) СН3СООК 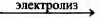
Г) СН3СООК 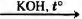
ПРОДУКТ РЕАКЦИИ
1) ацетальдегид
2) этанол
3) метан
4) этан
5) пропанон
6) уксусная кислота
Задана следующая схема превращений веществ:
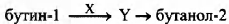
Определите, какие из указанных веществ являются веществами X и Y.
1) бутаналь
2) бутанон
3) серная кислота
4) гидроксид калия
5) вода
Из предложенного перечня выберите все реакции, которые не являются окислительно-восстановительными.
1. разложение оксида ртути(II)
2. разложение гидрокарбоната кальция
3. взаимодействие сероводорода с бромом
4. взаимодействие метана с кислородом
5. разложение гидроксида меди(II)
Из предложенного перечня выберите все факторы, от которых зависит скорость реакции, протекающей по схеме:
Zn + кислота = соль + H2
1. Присутствие индикатора
2. Состав кислоты
3. Давление
4. Концентрация кислоты
5. Концентрация соли
Установите соответствие между веществом и свойством, которое способен проявлять атом галогена, содержащийся в данном веществе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) F2
Б) KClO3
В) HBr
СВОЙСТВО ГАЛОГЕНА
1) только окислитель
2) только восстановитель
3) и окислитель, и восстановитель
4) ни окислитель, ни восстановитель
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) Al2(SO4)3
Б) NaBr
В) Hg(NO3)2
Г) AgF
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) металл и сера
2) водород и кислород
3) металл и галоген
4) металл и кислород
5) водород и галоген

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке убывания значения pH их водных растворов.
1) CH3COOH
2) K3PO4
3) HNO3
4) LiOH
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при понижении давления в системе: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
УРАВНЕНИЕ РЕАКЦИИ
А) 2NO(г) + O2(г) [math]\leftrightarrows[/math] 2N02(г) + Q
Б) НHO2(p-p) + Сl2(г) [math]\leftrightarrows[/math] 2НСl(г) + Q
В) HNO2(p-p) [math]\leftrightarrows[/math] H+(p-p) + NO-2(p-p) - Q
Г) SrOтв.) + СO2(г) [math]\leftrightarrows[/math] SrCO3(тв.)) + Q
НАПРАВЛЕНИЕ СМЕЩЕНИЯ РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили некоторое количество порошка графита и водяного пара. В результате протекания обратимой реакции C (тв.) + H2O (г.) ⇋ H2 (г.) + CO (г.) в реакционной системе установилось химическое равновесие, при котором концентрации водяного пара и водорода составили 0,2 моль/л и 0,3 моль/л соответственно. Определите исходную концентрацию H2O (X) и равновесную концентрацию CO (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить их водные растворы: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛЫ ВЕЩЕСТВ
А) KCl и K2SO4
Б) K2SO4 и K2SO3
В) АlСl3 и MgCl2
Г) НСl и HNO3
РЕАГЕНТ
1) BaCl2
2) Cu
3) NaOH
4) H2SO4
5) C2H5OH
Установите соответствие между названием химического продукта и способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ПРОДУКТА
А) керосин
Б) фенол
В) резина
Г) мазут
СПОСОБ ПОЛУЧЕНИЯ
1) полимеризация
2) вулканизация каучука
3) выделение из каменноугольной смолы
4) поликонденсация
5) перегонка нефти
Из 250 г раствора поваренной соли с массовой долей 15% выпарили 30 г воды. Определите массовую долю соли в полученном растворе.
Ответ:___________________%.
(Запишите число с точностью до целых.)
Определите количество теплоты, необходимое для разложения карбоната кальция в соответствии с термохимическим уравнением
СаСO3 = СаО + СO2 - 177 кДж, если в результате выделилось 44,8 л (н.у.) углекислого газа.
Ответ:____________________кДж.
(Запишите число с точностью до целых.)
Определите массу гидроксида натрия (кг), который может прореагировать с 2 кг кремнезёма. Содержание основного вещества в указанном кремнезёме составляет 72%, примеси с гидроксидом натрия не реагируют. (Запишите число с точностью до сотых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Ацетат аммония, гидроксид натрия, перманганат натрия, соляная кислота, нитрит натрия, оксид марганца(IV). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется раствор зеленого цвета, не выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
NaNO2 + 2NaMnO4 + 2NaOH = NaNO3 + 2Na2MnO4 + H2O
2) Указан электронный баланс
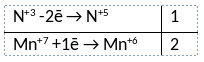
3) Указано, что марганец в степени окисления +7 (перманганат натрия) является окислителем, в азот в степени окисления +3 (нитрит натрия) является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции образуется слабое основание. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
CH3COONH4 + NaOH = CH3COONa + NH3∙H2O
2) Написано полное ионное уравнение:
CH3COO- + NH4+ + Na+ + OH- = CH3COO- + Na+ + NH3∙H2O
3) Написано сокращённое ионное уравнение:
NH4+ + OH- = NH3∙H2O
Медь растворили в концентрированной азотной кислоте, при этом наблюдали выделение бурого газа. Из полученного раствора выделили соль и прокалили её на воздухе. Получившийся чёрный порошок восстановили оксидом углерода(II). Продукт восстановления растворили в растворе хлорида меди(II) в присутствии избытка поваренной соли. Напишите уравнения четырёх описанных химических реакций.
1) Сu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2Н2O
2) 2Cu(NO3)2 = 2СuО + 4NO2 + O2
3) СuО + СО = Сu + СO2
4) Сu + СuСl2 + 2NaCl = 2Na[CuCl2]
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
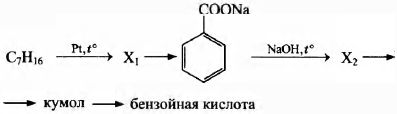
При написании уравнений реакций используйте структурные формулы органических веществ.
Некоторое органическое вещество, содержащее по массе 26,7% кислорода и 13,3% водорода, реагирует с калием и окисляется оксидом меди(II) с образованием кетона.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
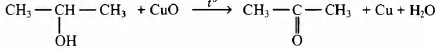
4) напишите уравнение взаимодействия данного вещества с оксидом меди.
2) молекулярная формула вещества С3Н8O
3) структурная формула 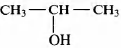
4) уравнение реакции
Для проведения электролиза (на инертных электродах) взяли 640 г 20%-ного раствора сульфата меди(II). После того, как масса раствора уменьшилась на 40 г, процесс остановили. К образовавшемуся раствору добавили 65 г порошка цинка. Определите массовую долю сульфата цинка в полученном растворе
Элементы ответа:
Записаны уравнения реакций:
1) 2CuSO4 + 2H2O = 2Cu + 2H2SO4 + O2
2) Zn + CuSO4 = ZnSO4 + Cu
3) Zn + H2SO4 = ZnSO4 + H2
m(CuSO4 исх.)[1] = 640 * 0,2 = 128 г
n(CuSO4 исх.)[1] = 128 / 160 = 0,8 моль
m(Cu полученной)[1] + m(O2 полученного)[1] = 40
64n(Cu полученной)[1] + 32n(O2 полученного)[1] = 40
n(Cu полученной)[1] = 2n(O2 полученного)[1]
128n(O2 полученного)[1] + 32n(O2 полученного)[1] = 40
160n(O2 полученного)[1] = 40
n(O2 полученного)[1] = 0,25 моль
n(H2SO4 полученной)[1] = 2n(O2 полученного)[1] = 0,5 моль
n(CuSO4 прореаг.)[1] = 2n(O2 полученного)[1] = 0,5 моль
n(CuSO4 ост.)[1] = n(CuSO4 исх.)[1] - n(CuSO4 прореаг.)[1]
n(CuSO4 ост.)[1] = 0,8 - 0,5 = 0,3 моль
n(CuSO4 исх.)[2] = n(CuSO4 ост.)[1] = 0,3 моль
n(H2SO4 исх.)[3] = n(H2SO4 полученной)[1] = 0,5 моль
n(Zn исх.)[2] и [3] = 65 / 65 = 1 моль
Zn в избытке по [2] и [3]
n(ZnSO4 полученного)[2] = n(CuSO4 исх.)[2] = 0,3 моль
n(ZnSO4 полученного)[3] = n(H2SO4 исх.)[3] = 0,5 моль
n(ZnSO4 полученного)[2] и [3] = 0,3 + 0,5 = 0,8 моль
m(ZnSO4 полученного)[2] и [3] = 0,8 * 161 = 128,8 г
n(Cu полученной)[2] = n(CuSO4 исх.)[2] = 0,3 моль
m(Cu полученной)[2] = 0,3 ∙ 64 = 19,2 г
n(H2 полученного)[3] = n(H2SO4 исх.)[3] = 0,5 моль
m(H2 полученного)[3] = 0,5 * 2 = 1 г
n(Zn прореаг.)[2] = n(CuSO4 исх.)[2] = 0,3 моль
n(Zn прореаг.)[3] = n(H2SO4 исх.)[3] = 0,5 моль
n(Zn прореаг.)[2] и [3] = 0,3 + 0,5 = 0,8 моль
m(Zn прореаг.)[2] и [3] = 0,8 * 65 = 52 г
mр-ра = 640 - 40 + 52 – 19,2 – 1 = 631,8 г
Определена массовая доля сульфата цинка в полученном растворе:
ω(ZnSO4) = 128,8 / 631,8 = 0,204, или 20,4%
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||