Вариант 25
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Определите, атомы каких из указанных в ряду элементов в основном состоянии не имеют на внешнем энергетическом уровне неспаренных электронов. Запишите в поле ответа номера выбранных элементов.
1. Al
2. Ca
3. P
4. Ne
5. Cl
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1) Br
2) F
3) N
4) Li
5) S
Из числа указанных в ряду элементов выберите два элемента, которые в высших оксидах проявляют степень окисления +4
1) Cl
2) Sn
3) Ge
4) Mg
5) Na
Из предложенного перечня выберите два соединения, в которых одна из ковалентных связей образована по донорно-акцепторному механизму.
1) CH3OH
2) CH3NH2
3) NH4HCO3
4) CH3CHO
5) CH3COONH4
Среди предложенных названий и формул веществ, расположенных в пронумерованных ячейках, выберите названия или формулы: А) нерастворимого основания, Б) кислотного оксида, В) одноосновной кислоты.
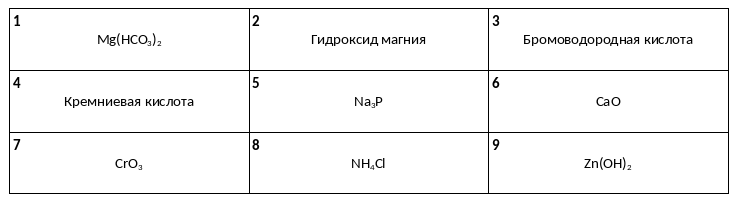
К одной из двух пробирок, содержащих раствор гидроксида бария, добавили раствор соли Х, а к другой – раствор соли Y. В результате в первой пробирке наблюдалось выпадение белого осадка, а во второй – выпадение серо-зеленого осадка. Определите вещества X и Y, которые могут вступать в описанные реакции.
1) H2SO4
2) AgNO3
3) FeCl2
4) NaHCO3
5) Cu(NO3)2
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) H2
Б) O2
В) Si
Г) Cl2
РЕАГЕНТЫ
1) N2, CO, CuO
2) C2H6, H2S, Fe
3) Cl2, KOH, Ca
4) CO2, HF, CH4
5) H2S, NaOH, K2SO4
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) O2
Б) Fe2O3
В) HCl
Г) K2S
РЕАГЕНТЫ
1) Fe, HCl, HNO3
2) AgNO3, KMnO4, NaOH
3) SiO2, N2, HNO3
4) HCl, CuSO4, HNO3
5) N2, CH4, H2S
Задана следующая схема превращений веществ:
NO2 —X→ KNO3 —Y→ KNO2
Определите, какие из указанных веществ являются веществами Хи Y.
1. КСl(р-р)
2. КОН(р-р)
3. NH3
4. H2SO4 (конц.)
5. C
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) толуол
Б) стирол
В) бутанол-1
КЛАСС/ГРУППА
1) спирты
2) амины
3) аминокислоты
4) углеводороды
Из предложенного перечня веществ выберите два вещества, которые являются межклассовыми изомерами.
1) циклогексен
2) метилциклопентан
3) гексен-2
4) гексан
5) пентадиен-1,3
Из предложенного перечня выберите все газообразные вещества, при пропускании каждого из которых через аммиачный раствор оксида серебра(I) будет наблюдаться выпадение осадка.
1) бутин-1
2) циклопропан
3) пропин
4) бутин-2
5) пропан
Из предложенного перечня выберите два вещества, которые могут подвергаться гидролизу.
1) рибоза
2) крахмал
3) фруктоза
4) этилацетат
5) дифениламин
Установите соответствие между названием реакции и её преимущественным продуктом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ РЕАКЦИИ
А) гидратация бутина-1
Б) гидратация бутина-2
В) гидрирование бутина-1
Г) гидратация этина
ПРОДУКТ РЕАКЦИИ
1) этанол
2) этаналь
3) бутаналь
4) бутнон
5) бутанол-1
6) бутан
Установите соответствие между схемой реакции и органическим веществом, которое является продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) HCOOK 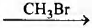
Б) (CH3COO)2Ca 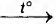
В) CH3CH2COOK 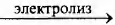
Г) C6H5COOK 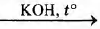
ПРОДУКТ РЕАКЦИИ
1) этан
2) метилформиат
3) бутан
4) ацетон
5) бензол
6) этаналь
Задана следующая схема превращений веществ:
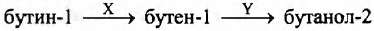
Определите, какие из указанных веществ являются веществами Х и Y.
1. водород
2. кислород
3. серная кислота (конц.)
4. гидроксид калия
5. вода
Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие карбоната кальция с соляной кислотой.
1. ионного обмена
2. окислительно-восстановительная
3. гетерогенная
4. каталитическая
5. обратимая
Из предложенного перечня реакций выберите все реакции, на скорость которых влияет степень измельчения металла, но не влияет изменение давления:
1. CuO + H2 = Cu + H2O
2. Zn + 2HCl (р-р) = ZnCl2 + H2
3. 6Li + N2 = 2Li3N
4. Mg + FeSO4 (р-р) = Fe + MgSO4
5. 3Fe + 2O2 = Fe3O4
Установите соответствие между схемой реакции и схемой изменения степени окисления серы в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) FeS2 + O2 → Fe2O3 + SO2
Б) SCl2 + HNO3 → H2SO4 + NO2 + HCl
В) Cu2S + HNO3 → CuSO4 + NO2 + H2O
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ СЕРЫ
1) S+2 → S+6
2) S–1 → S+4
3) S–1 → S+6
4) S–1 → S+6
5) S–2 → S+6
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) KMnO4
Б) KI
В) CuBr2
Г) AgNO3
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) металл и азот
2) водород и кислород
3) металл и галоген
4) металл и кислород
5) водород и галоген

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке возрастания значения pH их водных растворов.
1) Al(NO3)3
2) NH3
3) CH3COONH4
4) HClO3
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при повышении давления в системе: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
УРАВНЕНИЕ РЕАКЦИИ
А) 2SO2(r) + О2(r) [math]\leftrightarrows[/math] 2SO3(r)) + Q
Б) Вr2(r) + Н2(r) [math]\leftrightarrows[/math] 2НВг(r) + Q
В) НСООН(р.р) [math]\leftrightarrows[/math] HCOO-(р.р) + H+(p-p) - Q
Г) SrO(тв.) + СО2(r) [math]\leftrightarrows[/math] SrCO3(r) + Q
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили некоторое количество пропана и водяного пара. В результате протекания обратимой реакции C3H8 (г.) + 2H2O (г.) ⇋ 3CO (г.) + 7H2 (г.) в реакционной системе установилось химическое равновесие, при котором концентрации пропана, воды и монооксида углерода составили 0,2 моль/л, 0,2 моль/л и 0,6 моль/л соответственно. Определите исходную концентрацию C3H8 (X) и равновесную концентрацию H2 (Y).
Выберите из списка номера правильных ответов.
1) 0,4 моль/л
2) 0,6 моль/л
3) 0,8 моль/л
4) 1,0 моль/л
5) 1,2 моль/л
6) 1,4 моль/л
Установите соответствие между названиями веществ и реагентом, с помощью которого их можно различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЯ ВЕЩЕСТВ
А) этаналь и этанол
Б) метанол и уксусная кислота
В) этен и этин
Г) бутин-1 и бутин-2
РЕАГЕНТ
1) Na2CO3
2) Cu
3) [Ag(NH3)2]OH
4) H2SO4
5) KOH
Установите соответствие между названием высокомолекулярного соединения и его формулой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) поливинилхлорид
Б) полипропилен
В) тефлон
Г) полистирол
ФОРМУЛА
1) (—CF2 — CF2—)n
2) (—СН2 — СН(С6Н5)—)n
3) (—СН2 — СН(СН3)—)n
4) (—СН2 — С(Сl)Н—)n
5) (—СН2 — СН2—)n
Какую массу соли (в граммах) надо добавить к 300 г раствора с массовой долей хлорида калия 15% для получения раствора с массовой долей 17%?
Ответ:___________________г.
(Запишите число с точностью до десятых.)
В результате реакции, термохимическое уравнение которой
3Fe + 2O2 = Fe3O4 + 1200 кДж,
образовалось 23,2 г железной окалины. Какое количество теплоты (в кДж) выделилось при этом?
Ответ:___________________кДж.
(Запишите число с точностью до целых.)
При бромировании циклогексена массой 246 г было выделено 617,1 г продукта. Определите выход продукта реакции в процентах от теоретически возможного. (Запишите число с точностью до целых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Нитрат серебра, оксид азота(IV), оксид марганца(IV), иодид стронция, серная кислота, перманганат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется две соли и кислота. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
5NO2 + KMnO4 + H2O = Mn(NO3)2 + KNO3 + 2HNO3
2) Указан электронный баланс
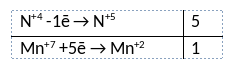
3) Указано, что марганец в степени окисления +7 (перманганат калия) является окислителем, а азот в степени окисления +4 (оксид азота(IV)) является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции образуется белый осадок. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
SrI2 + H2SO4 = SrSO4 + 2HI
2) Написано полное ионное уравнение:
Sr2+ + 2I- + 2H+ + SO42- = SrSO4 + 2H+ + 2I-
3) Написано сокращённое ионное уравнение:
Sr2+ + SO42- = SrSO4
Через раствор тетрагидроксоалюмината натрия пропустили избыток сероводорода до прекращения выпадения белого осадка. Соль, образовавшуюся в водном растворе, выделили и обработали перманганатом натрия в кислой среде. Образовавшееся простое вещество сожгли в кислороде, а полученный газ поглотили щелочным раствором, содержащим гипохлорит калия. Напишите уравнения четырёх описанных химических реакций.
1) Na[Al(OH)4] + H2S = Al(OH)3↓ + NaHS + H2O
2) 10NaHS + 4NaMnO4 + 11H2SO4 = 10S + 4MnSO4 = Na2SO4 + 16H2O
3) S + O2 = SO2
4) SO2 + KCIO + 2KOH = KCl + K2SO4 + H2O
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
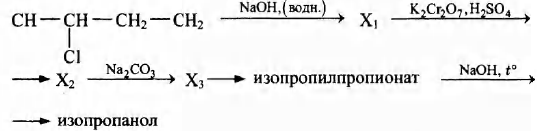
При написании уравнений реакций используйте структурные формулы органических веществ.
1) CH3—CH2—CHCl2 + 2NaOH → CH3—CH2—C(O)H + 2NaCl + H2O
2) 3CH3—CH2—C(O)H + K2Cr2O7 + 4H2SO4 → 3CH3—CH2—COOH + Cr2(SO4)3 + K2SO4 + 4H2O
3) 2CH3—CH2—COOH + Na2CO3 → 2CH3—СН2—COONa + H2O + CO2
4) СН3—СН2—COONa + CH3—CH(Br)—CH3 → CH3—CH2—COO—CH(CH3)2 + NaBr
5) CH3—CH2—COO—CH(CH3)2 + NaOH → CH3—CH2—COONa + CH3—CH(OH)—CH3
Некоторое органическое вещество при нагревании подвергается гидролизу под действием гидроксида бария с образованием двух солей. При сжигании образца этого вещества массой 3,808 г получено 9,856 г углекислого газа и 2,016 г воды.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение гидролиза данного вещества в присутствии гидроксида бария.
2) молекулярная формула вещества С8Н8O2
3) структурная формула
4) уравнение реакции
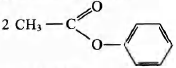 + 2Ва(ОН)2 → (СН3СОО)2Ва + (С6Н5O)2Ва + 2Н2O
+ 2Ва(ОН)2 → (СН3СОО)2Ва + (С6Н5O)2Ва + 2Н2O
Через 240 г 20% раствор сульфата меди (II) пропустили сероводород, в результате массовая доля сульфата меди понизилась до 2,15%. К получившемуся раствору прилили 128 г 25% раствора гидроксида натрия. Вычислите массовую долю гидроксида натрия в образовавшемся растворе.
Элементы ответа:
Записаны уравнения реакций:
CuSO4 + H2S → CuS + H2SO4
H2SO4 + 2NaOH → Na2SO4 + 2H2O
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
n(CuSO4) = 240*0,2 / 160 = 0,3 моль
Пусть n(H2S) = x моль
mкон.р-ра = m(CuSO4)р-ра + m(H2S) - m(CuS) = 240 + 34x - 96x = 240 -62x
m(CuSO4)ост. = 48-160х г
0,0215 = 48-160х / 240 - 62х ⇒ x = 0,27
n(CuSO4)ост.= 0,3 - 0,27 = 0,03 моль
n(NaOH) = 128*0,25 / 40 = 0,8 моль
m(NaOH)ост. = (0,8 - 0,6)*40 = 8 г
mкон.р-ра после NaOH = (240 - 62*0,27) + 128 - 0,03*98 = 348,32 г
w(NaOH) = 8 / 348,32 *100% = 2,3%
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||