Вариант 24
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне один неспаренный электрон. Запишите в поле ответа номера выбранных элементов.
1. K
2. Br
3. Se
4. Mg
5. P
Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке усиления их металлических свойств.
1) Ag
2) Cl
3) Ca
4) Br
5) K
Из числа указанных в ряду элементов выберите два элемента, которые в оксидах проявляют валентность IV.
1) C
2) Rb
3) Sr
4) Be
5) Si
Из предложенного перечня веществ выберите два соединения, в которых одна из ковалентных связей образована по донорно-акцепторному механизму.
1) LiOH
2) Li3PO4
3) (NH4)2HPO4
4) NH4F
5) H3PO4
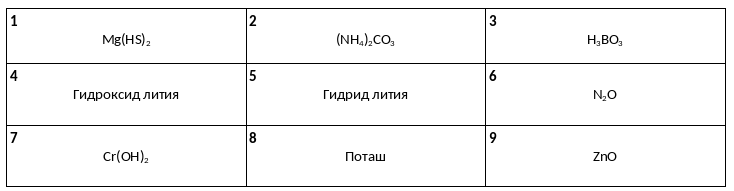
Среди предложенных названий и формул веществ, расположенных в пронумерованных ячейках, выберите названия или формулы, соответствующие: А) щёлочи, Б) кислой соли, В) несолеобразующему оксиду.
К одной из двух пробирок, содержащих раствор иодида кальция, добавили раствор соли Х, а к другой – раствор соли Y. В результате в первой пробирке наблюдалось только выпадение белого осадка, а во второй – выпадение ярко-желтого осадка. Определите вещества X и Y, которые могут вступать в описанные реакции.
1) нитрат свинца (II)
2) хлорид меди (II)
3) фтороводородная кислота
4) карбонат аммония
5) сульфид серебра
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) H2SO4 (p-p)
Б) Na2O
В) O2
Г) FeSO4
РЕАГЕНТЫ
1) CuO, Au, AgNO3
2) H2S, NaCl, Ag
3) CO2, SO2, H2O
4) NH3 (p-p), Zn, Ba(NO3)2
5) NH3 (г), CO, FeO
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) H2
Б) CaO
В) H2S
Г) Na2SO3
РЕАГЕНТЫ
1) КOН, СuСl2, O2
2) C, Al2O3, H2O
3) HCl, Ba(OH)2, O2
4) CuO, Li, C2H4
5) N2, CH4, H2SO4
Задана следующая схема превращений веществ:
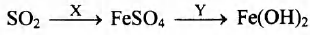
Определите, какие из указанных веществ являются веществами Х и Y.
1. Fe(OH)3
2. KOH(p-p)
3. H2
4. Fe2(SO4)3 (p-p)
5. H2O
Установите соответствие между названием вещества иO классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) кумол
Б) бутандиол-1,2
В) гексен-2
КЛАСС/ГРУППА
1) спирты
2) альдегиды
3) аминокислоты
4) углеводороды
Из предложенного перечня веществ выберите два вещества, которые являются межклассовыми изомерами.
1.этилацетат
2. цис-бутен-2
3. транс-бутен-2
4. бутановая кислота
5. метилпропиловый эфир
Из предложенного перечня выберите все вещества, при каталитическом гидрировании каждого из которых образуется циклоалкан.
1) толуол
2) пропин
3) бензол
4) циклогексен
5) циклобутан
Из предложенного перечня выберите два вещества, которые могут подвергаться гидролизу.
1) глюкоза
2) сахароза
3) фруктоза
4) глицилаланин
5) диметиламин
Установите соответствие между схемой реакции и её продуктом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) 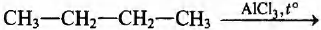
Б) СН2=СН2 +Н2O→
В) 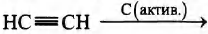
Г) 
ПРОДУКТ
1) бутен
2) ацетон
3) изобутан
4) этанол
5) бензол
6) этаналь
Установите соответствие между протекающей реакцией и продуктом, который образуется в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАКЦИЯ
А) гидрирование фенола
Б) дегидратация циклогексанола
В) дегидратация пропанола-1
Г) дегидратация пропанола-2
ПРОДУКТ
1) 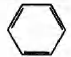
2) 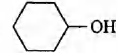
3) 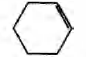
4) СН3 —СН=СН2
5) СН3—СН2—СН3
6) CH3—С [math]\equiv[/math] СН
Задана следующая схема превращений веществ:
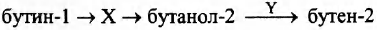
Определите, какие из указанных веществ являются веществами X и Y.
1) бутаналь
2) бутанон
3) серная кислота (конц.)
4) бромоводородная кислота
5) вода
Из предложенного перечня выберите все схемы, соответствующие реакциям обмена.
1. Fe(OH)3 → Fe2O3 + H2O
2. BaCl2 + H2SO4 → BaSO4 + HCl
3. Al + Fe2O3 → Fe + Al2O3
4. Al2S3 + H2O → Al(OH)3 + H2S
5. Fe + CuSO4 → Cu + FeSO4
Из предложенного перечня выберите все факторы, под действием которых увеличивается скорость реакции межмолекулярной дегидратации жидкого метанола.
1. Добавление водорода
2. Повышение температуры
3. Добавление воды
4. Использование катализатора
5. Увеличение объема сосуда
Установите соответствие между элементом и наиболее полным набором степеней окисления, которые данный элемент способен проявлять в сложных веществах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.ЭЛЕМЕНТ
А) O
Б) Cr
В) F
ПРОЯВЛЯЕМЫЕ СТЕПЕНИ ОКИСЛЕНИЯ
1) -1
2) +2, +3, +6
3) -1, +1, +3, +7
4) -2, +2, +4, +6
5) -2, -1, +1, +2
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) Li2SO4
Б) Na3PO4
В) MgCl2
Г) K2S
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) металл и сера
2) водород и кислород
3) металл и галоген
4) водород и галоген
5) водород и сера

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке возрастания значения pH их водных растворов.
1) KMnO4
2) CH3COOH
3) K2HPO4
4) H2SO4
Установите соответствие между способом воздействия на равновесную систему
Fe3O4(тв.) + СО(г) [math]\leftrightarrows[/math] 3FeO(тв.) + СO2г - Q
и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
ВОЗДЕЙСТВИЕ НА СИСТЕМУ
А) увеличение давления
Б) увеличение температуры
В) добавление катализатора
Г) уменьшение концентрации углекислого газа
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили диоксид хлора. При этом его исходная концентрация составляла 0,7 моль/л. В результате протекания обратимой реакции ClO2 (г.) ⇋ ½Сl2 (г.) + O2 (г.) в реакционной системе установилось химическое равновесие, при котором концентрация кислорода составила 0,4 моль/л. Определите равновесные концентрации ClO2 (X) и Cl2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Установите соответствие между формулами реагирующих веществ и признаком их взаимодействия: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) СН3СООН и NaOH
Б) FeCl3 и NaOH
В) NaHCO3 и НСООН
Г) АlСl3 и NH3 (р-р)
ПРИЗНАК РЕАКЦИИ
1) изменение окраски раствора
2) образование белого осадка
3) образование бурого осадка
4) выделение газа
5) видимые признаки отсутствуют
Установите соответствие между структурным звеном полимера и его названием: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СТРУКТУРНОЕ ЗВЕНО
А) —СН2—СН(СН3)—
Б) —CH2—СНСl—
В) —CH2—CH2—
Г) — СН2 — С(СН3) = CH— CH2 —
НАЗВАНИЕ ПОЛИМЕРА
1) фенолформальдегидная смола
2) полиэтилен
3) природный каучук
4) полипропилен
5) поливинилхлорид
Какую массу воды (в граммах) надо добавить к 300 г раствора с массовой долей хлорида калия 15% для получения раствора с массовой долей 10%?
Ответ:___________________г.
(Запишите число с точностью до целых.)
В результате реакции, термохимическое уравнение которой
3Fe + 2O2 = Fe3O4 + 1200 кДж,
выделилось 600 кДж теплоты. Найти массу (в граммах) окисленного железа.
Ответ:___________________г.
(Запишите число с точностью до целых.)
На взаимодействие с навеской технического сульфида натрия массой 130 г требуется соляная кислота, содержащая 102,2 г хлороводорода. Вычислите массовую долю (%) нерастворимых в кислоте примесей в указанном образце. (Запишите число с точностью до целых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Бромоводород, фосфин, гидрофосфат калия, бромид бария, карбонат меди(II), перманганат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется осадок бурого цвета и две соли одной кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
3PH3 + 8KMnO4 = 8MnO2 + 2K3PO4 + K2HPO4 + 4H2O
2) Указан электронный баланс
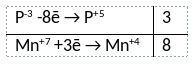
3) Указано, что марганец в степени окисления +7 (перманганат калия) является окислителем, а фосфор в степени окисления -3 (фосфин) является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции образуется белый осадок. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
K2HPO4 + BaBr2 = BaHPO4 + 2KBr
2) Написано полное ионное уравнение:
2K+ + HPO42- + Ba2+ + 2Br- = BaHPO4 + 2K+ + 2Br-
3) Написано сокращённое ионное уравнение:
HPO42- + Ba2+ = BaHPO4
Порошок серы сплавили с гидроксидом калия. Из двух образовавшихся при этом солей выделили одну, количество которой в смеси меньше, и обработали её разбавленной серной кислотой. Выделившийся газ пропустили через подкисленный раствор перманганата калия. Марганцевую соль выделили из полученного раствора и подвергли электролизу. Напишите уравнения четырёх описанных реакций.
1) 3S + 6КОН - 2K2S + K2SO3 + 3H2O
2) K2SO3 + H2SO4 = K2SO4 + H2O + SO2
3) 5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4
4) 2MnSO4 + 2H2O →электролиз→ 2Mn + O2 + 2H2SO4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
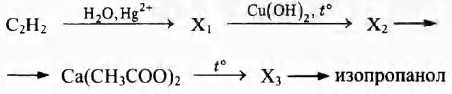
При написании уравнений реакций используйте структурные формулы органических веществ.
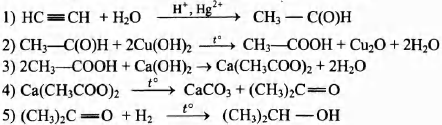
Некоторое органическое вещество получается при окислении циклического углеводорода С6Н10 перманганатом калия в присутствии серной кислоты. По данным химического анализа, в этом веществе массовая доля углерода равна 49,31%, массовая доля кислорода 43,84% и массовая доля водорода 6,85%.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение получения этого вещества окислением соответствующего углеводорода перманганатом калия в сернокислой среде.
2) молекулярная формула вещества С6Н10O4
3) структурная формула 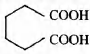
4) уравнение реакции 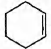 + 8КМnO4 +
+ 8КМnO4 +
12H2SO4 → 5НООС—(СН2)4—СООН + 8MnSO4 + 4K2SO4 + 12Н2O
Кристаллогидрат нитрата меди (II) содержит 51,01% по массе протонов. Порцию такого кристаллогидрата массой 44,4 г прокалили до прекращения изменения массы, твердый остаток растворили в избытке иодоводородной кислоты. Вычислите массу полученной соли.
Элементы ответа:
Записаны уравнения реакций:
(1) 2Cu(NO3)2 • 6Н2О = 2CuO + 4NO2 ↑ + O2 ↑ + 12Н2О ↑
(2) 2CuO + 4HI = 2CuI ↓ + I2 ↓ + 2H2O
Найдем состав кристаллогидрата
Пусть состав кристаллогидрата выражается Cu(NO3)2 • xH2O,
М(Cu(NO3)2 • xH2O) = 188 + 18x
Cu(NO3)2 содержит 91 протон, а xH2O − 10x протонов
ω(p+) = (91 + 10x) : (188 + 18x) = 0,5101
х = 6, значит формула кристаллогидрата Cu(NO3)2 • 6Н2О
Найдем количество иодида меди (I)
n(Cu(NO3)2 • 6Н2О) = m : M = 44,4 : 296 = 0,15 моль
n(CuI) = n(CuO) = n(Cu(NO3)2 • 6Н2О) = 0,15 моль
Найдем массу соли
m(CuI) = n • M = 191 • 0,15 = 28,65 г
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||