Вариант 23
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне два электрона. Запишите в поле ответа номера выбранных элементов.
1. N
2. Fe
3. As
4. Mg
5. P
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Na
2) K
3) Si
4) Mg
5) C
Из числа указанных в ряду элементов выберите два элемента, которые в оксидах проявляют степень окисления +1.
1) C
2) Cr
3) Cu
4) Be
5) N
Из предложенного перечня веществ выберите два вещества, для которых характерны следующие свойства: тугоплавкие, нерастворимы в воде, не проводят электрический ток в расплаве.
1) NH3
2) SiO2
3) Fe
4) NaCl
5) C (алмаз)
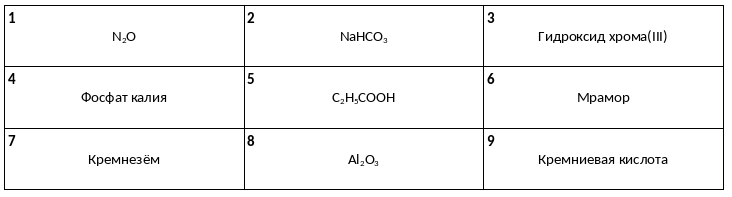
Среди предложенных названий и формул веществ, расположенных в пронумерованных ячейках, выберите названия или формулы, соответствующие: А) кислотному оксиду, Б) нерастворимой соли, В) одноосновной кислоте.
К одной из двух пробирок, содержащих раствор нитрата серебра, добавили раствор соли Х, а через другую пропустили газ Y. В результате в первой пробирке наблюдалось выпадение белого осадка, а во второй – выпадение черного осадка. Определите вещества X и Y, которые могут вступать в описанные реакции.
1) H2S
2) KI
3) NaOH
4) CaCl2
5) CO2
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) K
Б) CO2
В) HF
Г) Cu(NO3)2
РЕАГЕНТЫ
1) Na2S, KOH, HI
2) O2, H2, Cl2
3) SiO2, SO2, KCl
4) K2O, NaOH, C
5) K2O, Ca(OH)2, SiO2
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Н2
Б) Na2O
В) Сг(ОН)3
Г) СаСО3
РЕАГЕНТЫ
1) НСl, SiO2, Аl2O3
2) С, Сг2O3, ВаСl2
3) HNO3, NaOH, СН3СООН
4) СО, ZnO, НВг
5) O2, Na, С2Н2
Задана следующая схема превращений веществ: Na →X→ Na2O2 →Y→ Na2СО3 Определите, какие из указанных веществ являются веществами X и Y.
1. H2O2
2. NaOH
3. O2
4. K2CO3
5. CO2
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) этин
Б) ацетон
В) 2-аминобутан
КЛАСС/ГРУППА
1) кетоны
2) амины
3) аминокислоты
4) углеводороды
Из предложенного перечня веществ выберите два вещества, которые являются межклассовыми изомерами.
1) бутанол-1
2) цис-бутен-2
3) транс-бутеи-2
4) бутановая кислота
5) метилпропиловый эфир
Из предложенного перечня выберите все вещества, при взаимодействии каждого из которых с натрием протекает реакция замещения.
1) ацетилен
2) пропин
3) пентин-2
4) 3-метилбутин-1
5) толуол
Из предложенного перечня выберите два вещества, каждое из которых может образовывать дипептиды.
1) анилин
2) глицерин
3) аминоуксусная кислота
4) пропил амин
5) аланин
Установите соответствие между схемой реакции и её продуктом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) 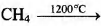
Б) СН3 — СН3 + HNO3 →
В) 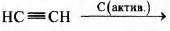
Г) 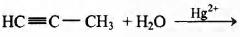
ПРОДУКТ
1) бензол
2) пропанон
3) ацетилен
4) этиламин
5) пропанол
6) нитроэтан
Установите соответствие между протекающей реакцией и продуктом, который образуется в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАКЦИЯ
А) окисление ацетальдегида
Б) гидрирование ацетальдегида
В) дегидратация метанола
Г) гидролиз метилата калия
ПРОДУКТ
1) CН3СНО
2) CН3СООН
3) HCHO
4) CH3CH2OH
5) CH3OCH3
6) CH3OH
Задана следующая схема превращений веществ:
пропин →X→ пропанол-2 →Y→ 2-бромпропан
Определите, какие из указанных веществ являются веществами Х и Y.
1) пропаналь
2) пропанон
3) бромид калия
4) бромоводородная кислота
5) бром
Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие раствора сульфата меди (II) с цинком.
1. обратимая
2. гетерогенная
3. замещения
4. обмена
5. окислительно-восстановительная
Из предложенного перечня выберите все внешние воздействия, которые увеличивают скорость химической реакции гидролиза этилацетата.
1. Охлаждение реакционной смеси
2. Увеличение концентрации этилацетата
3. Повышение температуры
4. Увеличение концентрации этанола
5. Добавление катализатора
Установите соответствие между схемой реакции и свойством, которое проявляет элемент азот в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) Na + NH3 → NaNH2 + H2
Б) NO2 + H2O → NO + HNO3
В) Cu(NO3)2 → CuO + NO2 + O2
СВОЙСТВО АЗОТА
1) только окислитель
2) только восстановитель
3) и окислитель, и восстановитель
4) не проявляет окислительно-восстановительных свойств
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) Ag2SO4
Б) K3PO4
В) CuCl2
Г) K2S
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) металл и сера
2) водород и кислород
3) металл и галоген
4) металл и кислород
5) водород и сера

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке возрастания значения pH их водных растворов.
1) KHS
2) Co(NO3)2
3) BaBr2
4) LiOH
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при понижении давления в системе: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
УРАВНЕНИЕ РЕАКЦИИ
A) C3H8(r) [math]\leftrightarrows[/math] C3H6(r) + H2(r) - Q
Б) C3H7OH(r) [math]\leftrightarrows[/math] C3H6(r) + H2O(r) - Q
В) FeCl2(p-p) + H2O(ж) [math]\leftrightarrows[/math] Fe(OH)Cl(p-p) + HCl(p-p) - Q
Г) 2CO2(r) [math]\leftrightarrows[/math] 2CO(r) + O2(r) - Q
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили монооксид азота и озон. При этом исходные концентрации монооксида азота и озона составляли 0,25 моль/л и 0,30 моль/л соответственно. В результате протекания обратимой реакции NO (г.) + O3 (г.) ⇋ NO2 (г.) + O2 (г.) В реакционной системе установилось химическое равновесие, при котором концентрация монооксида азота составила 0,05 моль/л. Определите равновесные концентрации O3 (X) и NO2 (Y).
Выберите из списка номера правильных ответов.
1) 0,05 моль/л
2) 0,10 моль/л
3) 0,15 моль/л
4) 0,20 моль/л
5) 0,25 моль/л
6) 0,30 моль/л
Установите соответствие между формулами реагирующих веществ и признаком их взаимодействия: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) HI и AgNO3
Б) Ca(NO3)2 и Na2CO3
В) FeCl3 и NaOH
Г) СаСО3 И HNO3 (конц.)
ПРИЗНАК РЕАКЦИИ
1) образование желтого осадка
2) образование белого осадка
3) образование бурого осадка
4) выделение бесцветного газа
5) выделение бурого газа
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) O3
Б) HC [math]\equiv[/math] CH
В) NaCl
Г) C4H10
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) обеззараживание воды
2) в качестве бытового газа
3) получение хлорвинила
4) производство удобрений
5) консервант в пищевой промышленности
Какую массу воды (в граммах) надо добавить к 150 г раствора с массовой долей глюкозы 20% для получения раствора с массовой долей 15%?
Ответ:___________________г.
(Запишите число с точностью до целых.)
В результате реакции, термохимическое уравнение которой
3Fe + 2O2 = Fe3O4 + 1200 кДж,
выделилось 240 кДж теплоты. Найдите объем кислорода (в литрах, н.у.), вступившего в реакцию.
Ответ:___________________л.
(Запишите число с точностью до целых.)
В результате нитрования 468 г бензола было получено 676,5 г нитробензола. Определите выход продукта реакции в процентах от теоретически возможного. (Запишите число с точностью до целых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Хромат натрия, бромид натрия, нитрит натрия, серная кислота, ацетат серебра, хлорид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется простое вещество и выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
2NaBr + 2H2SO4 = Br2 + SO2 + 2H2O + Na2SO4
2) Указан электронный баланс
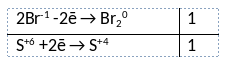
3) Указано, что сера в степени окисления +6 (серная кислота) является окислителем, а бром в степени окисления -1 (бромид натрия) является восстановителем.
Из предложенного перечня веществ выберите окрашенное соединение и вещество, которое вступают с ним в реакцию ионного обмена. В ходе реакции образуется осадок. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
Na2CrO4 + 2CH3COOAg = Ag2CrO4 + 2CH3COONa
2) Написано полное ионное уравнение:
2Na+ + CrO42- + CH3COO- + 2Ag+ = Ag2CrO4 + 2CH3COO- + 2Na+
3) Написано сокращённое ионное уравнение:
CrO42- + 2Ag+ = Ag2CrO4
Кристаллический иод обработали концентрированной азотной кислотой при нагревании, наблюдая выделение бурого газа. Образовавшуюся кислоту осторожно нагрели, при этом получился ангидрид этой кислоты. Полученный ангидрид прореагировал с угарным газом, а выделившееся простое вещество прореагировало с металлическим железом. Напишите уравнения четырёх описанных реакций.
1) I2 + 10HNO3(конц.) = 2НIO3 + 10NO2 + 4Н2O
2) 2НIO3 = I2O5 + Н2O
3) I2O5 + 5СО = I2 + 5СО2
4) Fe + I2 = Fel2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
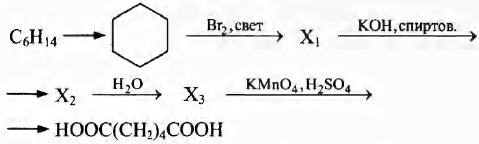
При написании уравнений реакций используйте структурные формулы органических веществ.
5) 5C6Н11ОН + 8KMnO4 + 12H2SO4 → 5НООС—(СН2)4—СООН + 8MnSO4 + 4K2SO4 + 17Н2O
Органическое вещество X может быть получено взаимодействием некоторого углеводорода Y с избытком брома (при использовании недостатка брома возможно образование других веществ, являющихся по отношению друг к другу структурными изомерами). При сжигании образца вещества X получено 2,24 л (н.у.) углекислого газа, 0,45 г воды и 8,1 г бромоводорода.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества X;
3) составьте возможную структурную формулу вещества X, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции получения вещества X взаимодействием углеводорода Y с избытком брома.
2) молекулярная формула вещества С4Н6Вr4
3) структурная формула СН2Вг—СНВr—СНВr—СН2Вr
4) уравнение реакции
СН2 = СН — СН = СН2 + 2Вг2 → СН2Вг — СНВг — СНВг — СН2Вг
Пластинку из сплава цинка со свинцом, в которой общее число электронов в 56 раз больше числа Авогадро, поместили в 100 г раствора хлорида олова (II). После того, как хлорид олова (II) прореагировал полностью, пластинку с осевшим на ней металлом, извлекли из раствора. При этом общее число электронов металлов, оставшихся в пластинке из металла, по сравнению с исходным числом электронов пластинки увеличилось на 12,5%. К оставшемуся раствору добавили 480 г 20% - ного раствора гидроксида натрия. Вычислите массовую долю щелочи в конечном растворе.
Элементы ответа:
Записаны уравнения реакций:
1) Zn + SnCl2 = ZnCl2 + Sn
2) ZnCl2 + 4NaOH = Na2[Zn(OH)4] + 2NaCl
Пусть nпрореаг.(Zn) = x моль
Тогда nвыделивш.(Sn) = x моль
nэ общ. * 0,125 = nэ(Sn) - nэ(Zn)
nэ общ.= N / NA = (56 * 6,02 * 1023) / (6,02 * 1023) = 56 моль
nэ(Sn) = 50x
nэ(Zn) = 30x
56 * 0,125 = 50x - 30x
20x = 7
x = 7 / 20
nпроереаг.(Zn) = nвыделивш.(Sn) = n(ZnCl2) = n(SnCl2) = 0,35 моль
m(NaOH) = mр-ра * w(NaOH) = 480 * 0,2 = 96 г
n(NaOH) = m / M = 96 / 40 = 2,4 моль
nост.(NaOH) = n - nпрореаг. = 2,4 - 0,35 * 4 = 1 моль
mост.(NaOH) = n * M = 1 * 40 = 40 г
mр-ра = mр-ра(ZnCl2) + m(Zn) - m(Sn) + mр-ра(NaOH) = 100 + 0,35 * 65 - 0,35 * 119 + 480 = 561,1 г
wост.(NaOH) = mост.(NaOH) / mр-ра = 40 / 561,1 = 0,0713 (7,13%)
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||