Вариант 22
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне один электрон. Запишите в поле ответа номера выбранных элементов.
1. Na
2. O
3. Se
4. Cu
5. S
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
1) Na
2) Si
3) Mg
4) C
5) O
Из указанных в ряду элементов выберите два элемента, степень окисления которых в высших оксидах равна +4
1) B
2) Sn
3) Cr
4) N
5) C
Из предложенного перечня выберите два вещества, которые имеют наибольшие температуры плавления.
1) Кристаллическая сера
2) Фтороводород
3) Алмаз
4) Кварц
5) Аммиак
Среди предложенных названий и формул веществ, расположенных в пронумерованных ячейках, выберите названия или формулы, соответствующие: А) нерастворимому основанию, Б) средней соли, В) двухосновной кислоте.
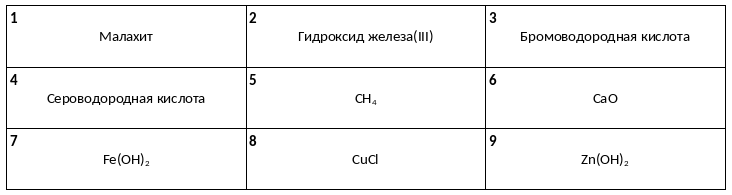
К двум пробиркам, содержащим раствор сульфата цинка, добавили растворы веществ X и Y, соответственно. В результате в первой пробирке наблюдалось выпадение белого осадка, растворимого в кислотах, а во второй – выпадение осадка, легкорастворимого как в кислотах, так и в щелочах. Определите вещества X и Y, которые могут вступать в описанные реакции.
1) H2CO3
2) BaCl2
3) K2S
4) FeO
5) KOH
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) K2SO4
Б) H2
В) SO2
Г) Al(OH)3
РЕАГЕНТЫ
1) H2SO4, KHCO3, O2
2) NaOH, O2, Ba(OH)2
3) Ba(OH)2, HCl, HI
4) N2, Na, K
5) Sr(NO3)2, Pb(NO3)2, BaBr2
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Na
Б) SiO2
В) Ba(OH)2
Г) FeCl3
РЕАГЕНТЫ
1) Mg, Са(ОН)2, Na2CO3
2) Na2O, Н2O, Fe
3) HNO3, Н2O, АlСl3
4) HCl,NH4Cl, Al
5) CaO, Н2, Mg
Задана следующая схема превращений веществ:
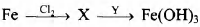
Определите, какие из указанных веществ являются веществами Х и Y.
1. FeCl2
2. H2O
3. FeCl3
4. C2H5OH
5. NH3 (p-p)
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) изопропанол
Б) аланин
В) метаналь
КЛАСС/ГРУППА
1) альдегиды
2) амины
3) аминокислоты
4) спирты
Из предложенного перечня веществ выберите два вещества, которые имеют цис-, транс-изомеры.
1. 2-метилбутен-2
2. бутен-1
3. бутен-2
4. 1,2-дихлорэтен
5. бутин-2
Из предложенного перечня выберите все вещества, при взаимодействии каждого из которых с хлором протекает реакция замещения.
1) пропан
2) этилен
3) циклогексан
4) бутадиен
5) циклопропан
Из предложенного перечня выберите два вещества, с которыми взаимодействует аминоуксусная кислота.
1) гидроксид бария
2) азот
3) азотная кислота
4) серебро
5) гексан
Установите соответствие между названием реакции и её преимущественным продуктом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ РЕАКЦИИ
А) гидратация пропина
Б) гидратация бутина-2
В) гидрирование пропина
Г) гидратация этина
ПРОДУКТ РЕАКЦИИ
1) пропан
2) пропаналь
3) пропанон
4) бутаналь
5) бутанон
6) этаналь
Установите соответствие между схемой реакции и реагентом X, который принимает в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) фенол →X→ трибромфенол
Б) бутаналь →X→ масляная кислота
В) глицерин →X→ 1,2,3-трибромпропан
Г) этанол →X→ этилформиат
РЕАГЕНТ X
1) CuO
2) H2 (кат.)
3) HBr
4) Br2
5) KMnO4 (H+)
6) НСООН
Задана следующая схема превращений веществ:
этен →X→ этанол →Y→ этен
Определите, какие из указанных веществ являются веществами X и Y.
1) НСl
2) NaOH (водн.)
3) СuО(t°)
4) Н2O (кат.)
5) H2SO4(t°)
Из предложенного перечня выберите все типа реакций, к которым можно отнести реакцию лития и азота при комнатной температуре.
1. гомогенная
2. гетерогенная
3. обратимая
4. не окислительно-восстановительная
5. реакция соединения
Из предложенного перечня выберите все факторы, под действием которых скорость реакции, протекающей по схеме:
А (тв) + 2В → 3С (г) + D + Q, всегда увеличивается.
1. Измельчение вещества А
2. Добавление индикатора
3. Нагревание реакционного сосуда
4. Повышение давления
5. Повышение концентрации вещества D
Установите соответствие между схемой реакции и схемой изменения степени окисления восстановителя в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) H2O2 + Cl2 → O2 + HCl
Б) MnO2 + HCl → MnCl2 + Cl2 + H2O
В) KOH + Cl2 → KCl + KClO + H2O
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
1) 0 → –1
2) –1 → 0
3) –2 → 0
4) +4 → +2
5) 0 → +1
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) MgSO4
Б) KF
В) CuCl2
Г) Na2S
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) металл и сера
2) водород и кислород
3) металл и галоген
4) металл и кислород
5) водород и сера

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке убывания значения pH их водных растворов.
1) Гашеная известь
2) Калиевая селитра
3) Гидроксид хрома (VI)
4) Пищевая сода
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при повышении давления в системе: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
УРАВНЕНИЕ РЕАКЦИИ
А) С3Н6(г) + Н2(г) [math]\leftrightarrows[/math] С3Н8(г)+ Q
Б) С3Н7ОН(г) [math]\leftrightarrows[/math] С3Н6(г) + Н2O(г) - Q
В) ZnCl2(p-P) + Н2O(ж) [math]\leftrightarrows[/math] Zn(OH)Cl(p-p) + HCl (p-p) - Q
Г) 2СО(г) + O2(г) [math]\leftrightarrows[/math] 2СO2(г) + Q
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили диоксид серы и диоксид азота. При этом концентрация диоксида серы составляла 0,5 моль/л. В результате протекания обратимой реакции SO2 (г.) + NO2 (г.) ⇋ SO3 (г.) + NO (г.) в реакционной системе установилось химическое равновесие, при котором концентрации диоксида азота и монооксида азота составили 0,1 моль/л и 0,3 моль/л соответственно. Определите равновесную концентрацию SO2 (X) и исходную концентрацию NO2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Установите соответствие между формулами реагирующих веществ и признаком их взаимодействия: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) NaHCO3 и H2SO4 (разб.)
Б) ВаСl2 и К3РО4
В) Na2CrO4 и AgNO3
Г) NaHCO3 и HNO3 (конц.)
ПРИЗНАК РЕАКЦИИ
1) образование желтого осадка
2) образование белого осадка
3) образование бурого осадка
4) выделение бесцветного газа
5) выделение бурого газа
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) этилацетат
Б) пропан
В) уксусная кислота
Г) пропилен
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) получение капрона
2) в качестве бытового газа
3) в качестве растворителя
4) консервант в пищевой промышленности
5) получение полимеров
К 300 г раствора с массовой долей бромида кальция 6% добавили 50 мл воды и 20 г соли. Определите массовую долю соли в полученном растворе.
Ответ:___________________%.
(Запишите число с точностью до десятых.)
Определите объём метана (в литрах, н.у.), при сгорании которого в соответствии с термохимическим уравнением
СН4 + 2O2 = СO2 + 2Н2O + 892 кДж выделится 297,3 кДж теплоты.
Ответ:___________________л.
(Запишите число с точностью до десятых.)
Образец сульфида алюминия массой 25 г с содержанием примесей 10% поместили в раствор гидроксида калия, взятый в избытке. Определите массу тетрагидроксоалюмината калия (г), который образовался при этом. (Запишите число с точностью до десятых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Бромоводородная кислота, гидросульфат калия, перманганат калия, графит, нитрат серебра, ацетат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется простое вещество. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
2KMnO4 + 16HBr = 5Br2 + 2MnBr2 + 2KBr + 8H2O
2) Указан электронный баланс
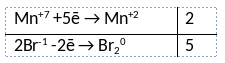
3) Указано, что марганец в степени окисления +7 (перманганат калия) является окислителем, а бром в степени окисления -1 (бромоводородная кислота) является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции образуется белый осадок. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
KHSO4 + (CH3COO)2Ba = BaSO4 + CH3COOK + CH3COOH
2) Написано полное ионное уравнение:
K+ + HSO4- + 2CH3COO- + Ba2+ = BaSO4 + CH3COO- + K+ + CH3COOH
3) Написано сокращённое ионное уравнение:
HSO4- + CH3COO- + Ba2+ = BaSO4 + CH3COOH
Металлическое железо обработали хлором, а полученный продукт растворили в воде и обработали сульфидом аммония. Выпавший чёрный осадок растворили в концентрированной азотной кислоте, при этом наблюдали выделение бурого газа, для утилизации которого использовали раствор кальцинированной соды. Напишите уравнения четырёх описанных реакций.
1) 2Fe + 3Cl2 = 2FeCl3
2) 2FeCl3 + 3(NH4)2S = 2FeS + 6NH4CI + S↓
3) FeS + 6HО3(конц.) = S↓ + Fe(NO3)3 + 3NO2↑ + 3H2O
4) 2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
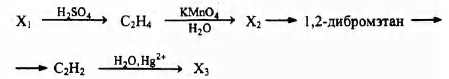
При написании уравнений реакций используйте структурные формулы органических веществ.
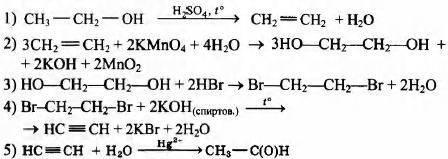
При окислении углеводорода С5Н8 перманганатом калия в сернокислой среде было получено органическое вещество А, содержащее по массе 61,54% кислорода, 34,62% углерода и 3,84% водорода.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества А;
2) запишите молекулярную формулу органического вещества А;
3) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение получения вещества А окислением углеводорода C5H8 перманганатом калия в сернокислой среде.
2) молекулярная формула вещества С3Н4O4
3) структурная формула 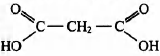
4) уравнение реакции СН2=СН—СН2 — СН = СН2 + 4КМnO4 + 6H2SO4 → НООС—СН2—СООН + 4MnSO4 + 2K2SO4 + 2СO2 + 8Н2O
Через 500 г раствора хлорида бария, в котором 53% от общей массы раствора составляет масса протонов в ядрах всех атомов, пропускали электрический ток до тех пор, пока на аноде не выделилось 896 мл (н. у.) газа. К образовавшемуся в результате электролиза раствору добавили 63,6 г карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физических величин).
Элементы ответа:
Записаны уравнения реакций:
(1) BaCl2 + 2H2O = Ba(OH)2 + H2 + Cl2 (электролиз)
(2) BaCl2 + Na2CO3 = 2NaCl + BaCO3
(3) Ba(OH)2 + Na2CO3 = 2NaOH + BaCO3
1 моль ВаСl2 содержит 90 моль протонов.
1 моль H2O содержит 10 моль протонов.
m(протонов) = 500 • 0,53 = 265 г
n(протонов) = 265 моль
Пусть в смеси было x моль BaCl2 и y моль H2O.
Тогда
90x + 10y = 265
208x + 18y = 500
x = n(BaCl2) = 0.5 моль
y = n(H2O) = 22 моль
n(Cl2) = 0,896 / 22,4 = 0,04 моль
n(H2) = n(Cl2) = 0,04 моль
m(H2) = 0,08 г
m(Cl2) = 0,04 • 71 = 2,84 г
n(Na2CO3) = 63,6 : 106 = 0,6 моль
n(Na2CO3 осталось) = n(Na2CO3) − n(BaCl2 исходный) = 0,6 − 0,5 = 0,1 моль
m(Na2CO3) = 0,1 • 106 = 10,6 г
n(BaCO3) = n(BaCl2 исходный) = 0,5 моль
m(BaCO3) = 0,5 • 197 = 98,5 г
m(конечного раствора) = 500 + 63,6 − 0,08 − 2,84 − 98,5 = 462,18 г
ω(Na2SO4) = 10,6 : 462,18 • 100 = 2,3%
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||