Вариант 20
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне два электрона. Запишите в поле ответа номера выбранных элементов.
1. Mg
2. S
3. Ti
4. Al
5. Ne
Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания их электроотрицательности.
1) Mg
2) P
3) N
4) O
5) Ti
Из числа указанных в ряду элементов выберите два элемента, которые образуют водородное соединение состава RH3. Запишите в поле ответа номера выбранных элементов.
1) F
2) N
3) Al
4) C
5) S
Из предложенного перечня веществ выберите два вещества, для которых в твердом состоянии характерны следующие свойства: пластичные, обладают высокой электро- и теплопроводностью.
1) сера
2) серебро
3) хлорид натрия
4) вода
5) медь
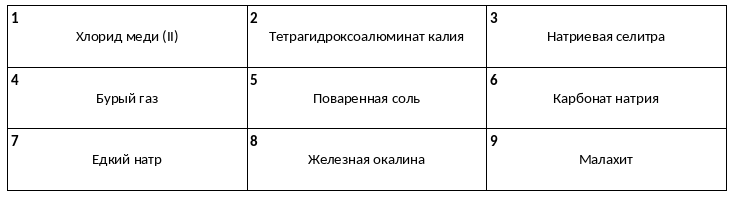
Среди предложенных названий веществ, расположенных в пронумерованных ячейках, выберите названия: А) соли азотной кислоты, Б) кислотного оксида, В) основного гидроксида.
К одной из двух пробирок, содержащих раствор серной кислоты, добавили раствор вещества Х, а к другой – раствор соединения натрия Y. В результате в каждой пробирке реакция протекала без видимых признаков. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) BaCl2
2) NaOH
3) Na2CO3
4) NH3
5) KHS
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) SO2
Б) Ca(OH)2 (p-p)
В) Na2CO3
Г) CuO
РЕАГЕНТЫ
1) Cu(OH)2, O2, MgCl2
2) O2, HNO3, FeCl3 (p-p)
3) H2SO4, HCl, Zn(NO3)2
4) H2, HCl, NH3
5) HNO3, BaSO4, K3PO4
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) O2
Б) P2O5
В) Al(OH)3
Г) MgBr2
РЕАГЕНТЫ
1) NaOH, СаО, Н2O
2) КОН, AgNO3, NH3 H2O
3) NH3 H20, SiO2, CH3COOH
4) КОН, SO3, HNO3
5) SO2,CO,K2SO3
Задана следующая схема превращений веществ:
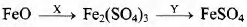
Определите, какие из указанных веществ являются веществами Хи Y.
1. Fe
2. H2SO4 (разб.)
3. NH3 (p-p)
4. H2SO4 (конц.)
5. Br2 (p-p)
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) глицерин
Б) глицин
В) стирол
КЛАСС/ГРУППА
1) альдегиды
2) спирты
3) аминокислоты
4) углеводороды
Из предложенного перечня веществ выберите два вещества, которые являются изомерами этилацетата:
1) уксусная кислота
2) бутановая кислота
3) пропановая кислота
4) изопропиловый эфир муравьиной кислоты
5) пропиловый эфир уксусной кислоты
Из предложенного перечня выберите все вещества, которые вступают в реакцию полимеризации.
1) пропан
2) изопрен
3) изобутан
4) стирол
5) бутан
Из предложенного перечня выберите два вещества, с которыми взаимодействует глицин.
1) гидроксид натрия
2) угарный газ
3) соляная кислота
4) медь
5) метан
Установите соответствие между названием реакции и её преимущественным продуктом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ РЕАКЦИИ
А) пиролиз метана
Б) гидрирование бензола
В) гидрирование циклопропана
Г) дегидрирование пропана
ПРОДУКТ РЕАКЦИИ
1) метанол
2) пропен
3) пропан
4) циклопропан
5) ацетилен
6) циклогексан
Установите соответствие между схемой реакции и реагентом X, который принимает в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) фенол → X → циклогексанол
Б) этаналь → X → уксусная кислота
В) толуол → X → бензоат калия
Г) этанол → X → уксусная кислота
РЕАГЕНТ X
1) CuO
2) H2 (кат.)
3) KOH
4) KMnO4 (водн.)
5) KMnO4 (H+)
6) H2SO4 (конц.)
Задана следующая схема превращений веществ:
этаналь → Y → уксусная кислота → X → метан
Определите, какие из указанных веществ являются веществами Хи Y.
1. этанол
2. CH3COONa
3. 1,2-дихлорэтан
4. Cu(OH)2
5. H2SO4 ([math]t^\circ[/math])
Из предложенного перечня выберите все вещества, которые вступают с гидроксидом натрия в окислительно-восстановительную реакцию.
1. NO2
2. P
3. HNO3
4. Zn
5. CO2
Из предложенного перечня схем реакций выберите все реакции, на скорость которых влияет добавление хлорида алюминия:
1. н-С4H10 → CH3CH(CH3)CH3
2. Al + Cl2 → AlCl3
3. С6H6 + Cl2 → C6H5Cl + HCl
4. Al + HCl → AlCl3 + H2
5. AlCl3 + NaOH → Al(OH)3 + NaCl
Установите соответствие между схемой реакции и значением степени окисления восстановителя в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) NH3 + O2 → NO + H2O
Б) S + HNO3 → H2SO4 + NO
В) SO2 + H2S → S + H2O
СТЕПЕНЬ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
1) –2
2) 0
3) +4
4) –3
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) Al2(SO4)3
Б) ВаВг2
В) Cu(NO3)2
Г) AgF
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) металл и сера
2) водород и кислород
3) металл и галоген
4) металл и кислород
5) водород и галоген

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке убывания значения pH их водных растворов.
1) Ca(ClO)2
2) NaCl
3) NH4ClO4
4) HClO4
Установите соответствие между способом воздействия на равновесную систему
2СО(г) + О2(г) [math]\leftrightarrows[/math] 2СО2(г) + Q
и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
ВОЗДЕЙСТВИЕ НА СИСТЕМУ
А) уменьшение концентрации оксида углерода(II)
Б) уменьшение концентрации кислорода
В) увеличение давления
Г) увеличение температуры
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили оксид азота(II) и хлор. При этом исходная концентрация хлора составляла 0,15 моль/л. В результате протекания обратимой реакции 2NO (г.) + Cl2 (г.) ⇋ 2NOCl (г.) в реакционной системе установилось химическое равновесие, при котором концентрации оксида азота(II) и хлора составили по 0,05 моль/л. Определите исходную концентрацию NO (X) и равновесную концентрацию NOCl (Y).
Выберите из списка номера правильных ответов.
1) 0,05 моль/л
2) 0,10 моль/л
3) 0,15 моль/л
4) 0,20 моль/л
5) 0,25 моль/л
6) 0,30 моль/л
Установите соответствие между формулами веществ и реагентом, с помощью которого можно их различить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛЫ ВЕЩЕСТВ
А) пропан и пропен
Б) пропанол-1 и глицерин
В) пропанол-2 и пропионовая кислота
Г) фруктоза (р-р) и этанол
РЕАГЕНТ
1) Сu(ОН)2
2) Br2 (p-p)
3) C2H5OH
4) NaCl
5) H2SO4
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) фосфорная кислота
Б) метан
В) ацетон
Г) кокс
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) получение удобрений
2) в качестве топлива
3) в качестве растворителя
4) производство чугуна
5) получение полимеров
К 105 г раствора с массовой долей хлорида натрия 10% добавили 40 мл воды и 10 г соли. Определите массовую долю соли в полученном растворе.
Ответ:____________________%.
(Запишите число с точностью до десятых.)
Определите количество теплоты, которая выделится при образовании 90 г воды в соответствии с термохимическим уравнением
СH4 + 2O2 = СO2 + 2Н2O + 892 кДж
Ответ:___________________кДж.
(Запишите число с точностью до целых.)
Образец оксида меди(II), содержащий примесь меди, поместили в разбавленный раствор серной кислоты. При этом образовалось 176 г сульфата меди(II). Определите массу указанного образца (г), если массовая доля оксида в образце 88%. (Запишите ответ с точностью до целых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Пероксид водорода, сульфид цинка, гидроксид калия, гидроксид хрома(III), сульфат аммония, хлорид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется раствор жёлтого цвета. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
2) Указан электронный баланс
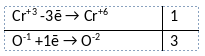
3) Указано, что кислород в степени окисления -1 (пероксид водорода) является окислителем, а хром в степени окисления +3 (гидроксид хрома(III)) является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции образуется слабое основание. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
(NH4)2SO4 + 2KOH = K2SO4 + 2NH3∙H2O
2) Написано полное ионное уравнение:
2NH4+ + SO42- + 2K+ + 2OH- = 2K+ + SO42- + 2NH3∙H2O
3) Написано сокращённое ионное уравнение:
NH4+ + OH- = NH3∙H2O
Гидроксид хрома(III) обработали в щелочной среде хлором. Полученный жёлтый раствор после подкисления серной кислотой измененил цвет на оранжевый. Соль, образовавшуюся в растворе, выделили и нагрели с концентрированной бромоводородной кислотой. Образовавшееся при этом простое вещество растворили в тёплом растворе едкого натра. Напишите уравнения четырёх описанных реакций.
1) 2Сг(ОН)3 + 10КОН + ЗСl2 = 2К2СrO4 + 6КСl + 8Н2O
2) 2К2СrO4 + H2SO4 = К2Сг2O7 + K2SO4 + Н2O
3) К2Сг2O7 + 14НВг = 2СrВг3 + 2КВг + ЗВг2 + 7Н2O
4) 3Br2 + 6NaOH = 5NaBr + NaBrO3 + 3H2O
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
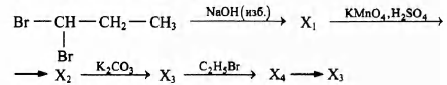
При написании уравнений реакций используйте структурные формулы органических веществ.
1) СН3—СН2—CHBr2 + 2NaOH → 2NaBr + Н2O + СН3—СН2—С(O)Н
2) 5СН3—СН2—С(O)Н + 2КМnO4 + 3H2SO4 → 5СН3—СН2—СООН + 2MnSO4 + K2SO4 + 3H2O
3) 2СН3—СН2—СООН + К2СO3 → 2СН3—СНr—COOK + СO2 + Н2O
4) СН3—СНr—COOK + С2Н5Вг → СН3—СНг—СОО—С2Н5 + КВг
5) СН3—СН2—СОО—С2Н5 + КОН → СН3—СНг—COOK + С2Н5ОН
При сгорании 12,6 г органического вещества, в молекуле которого содержится один третичный атом углерода, получили 20,16 л (н.у.) углекислого газа и 16,2 г воды. Относительная плотность паров этого вещества по углекислому газу равна 1,909. Известно, что это вещество не взаимодействует с водой, но реагирует с бромом на свету.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение взаимодействия данного вещества с бромом.
2) молекулярная формула вещества C6H12
3) структурная формула 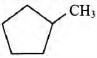
4) уравнение реакции 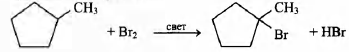
Железную пластинку полностью растворили в 500 г раствора азотной кислоты. При этом выделилась смесь оксида азота (II) и оксида азота (IV), в которой число молекул составляет 5,418*1023. В полученной смеси оксидов азота соотношение числа атомов кислорода к числу атомов азота равно 5:3. Вычислите массовую долю соли в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Элементы ответа:
Записаны уравнения реакций:
1) Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
2) Fe + 6HNO3 = Fe(NO3)3 + 3NO2 + 3H2O
Расчёт количества вещества реагентов и масса продуктов реакций:
n(смеси газов) = 5,418*1023 / 6,02*1023 = 0,9 моль
Пусть
n(NO2) = x моль
Тогда
n(NO) = (0,9 - x) моль
n(атомов N в смеси) = 0,9 моль
n(атомов O в смеси) = 2x + (0,9 - x) = (x + 0,9) моль
(x + 0,9) / 0,9 = 5 / 3
n(NO2) = x = 0,6 моль
n(NO) = 0,3 моль
m(NO2) = 0,6 * 46 = 27,6 г
m(NO) = 0,3 * 30 = 9 г
n(Fe(1)) = n(NO) = 0,3 моль
n(Fe(2)) = 1/3 n(NO2) = 0,2 моль
n(Fe) = n(Fe(1)) + n(Fe(2)) = 0,5 моль
m(Fe) = 0,5 * 56 = 28 г
n(Fe(NO3)3) = n(Fe) = 0,5 мольm(Fe(NO3)3) = 0,5 * 242 = 121 г
Вычисление массовой доли соли в растворе:
m(р-ра)= 28 + 500 - 27,6 - 9 = 491,4 г
w(Fe(NO3)3) = 121 / 491,4 = 0,246 или 24,6%
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||