Вариант 18
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне два электрона. Запишите в поле ответа номера выбранных элементов.
1. Na
2. Fe
3. Si
4. Mg
5. C
Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания окислительных свойств соответствующих им простых веществ.
1) F
2) Al
3) Br
4) Zn
5) H
Из числа указанных в ряду элементов выберите два элемента, у каждого из которых валентность в высших оксидах и в летучих водородных соединениях одинаковая.
1) O
2) Se
3) Si
4) C
5) N
Из предложенного перечня выберите два вещества молекулярного строения с ковалентной полярной связью
1) CH4
2) Na2SO4
3) Cl2
4) HCOOH
5) CaO
Среди предложенных названий веществ, расположенных в пронумерованных ячейках, выберите названия: А) одноосновной кислоты, Б) основного оксида, В) основания.
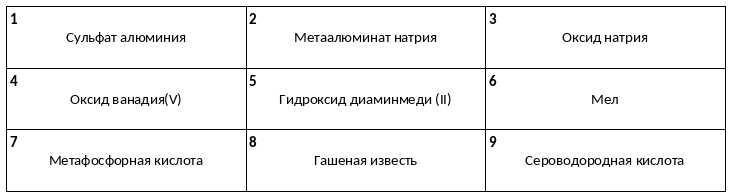
К двум пробиркам, содержащим, соответственно, сухие гидроксид X и вещество Y, добавили соляную кислоту. После завершения реакций в каждой из пробирок образовался окрашенный раствор и не осталось осадка на дне. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) Zn(OH)2
2) Fe(OH)3
3) (CuOH)2CO3
4) PbS
5) BaCO3
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Zn
Б) Cr2O3
В) H3PO4
Г) K2CO3
РЕАГЕНТЫ
1) S, CuSO4, HCl
2) Al(OH)3, SO2, Li3PO4
3) Ca, NH3, Zn(OH)2
4) H2SO4, KOH, Al
5) HBr, BaCl2, HNO3
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) S
Б) SO2
В) Pb(OH)2
Г) CaI2
РЕАГЕНТЫ
1) AgNO3, K3PO4, Cl2
2) BaO, H2O, NaOH
3) Cu, Cl2, O2
4) HBr, Ba(OH)2, HCOOH
5) H2SiO3, SrCl2, FeO
Задана следующая схема превращений веществ:
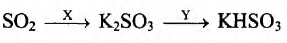
Определите, какие из указанных веществ являются веществами Хи Y.
1. КСl (р-р)
2. KOH
3. H2
4. H2SO4 (конц.)
5. SO2(p-p)
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) диэтилбензол
Б) глицин
В) 2-метилбутаналь
КЛАСС/ГРУППА
1) альдегиды
2) амины
3) аминокислоты
4) углеводороды
Из предложенного перечня выберите два вещества, которые являются структурными изомерами бутена-2.
1) циклобутан
2) бутан
3) бутан-1
4) бутадиен-1,3
5) метилпропен
Из предложенного перечня выберите все реакции, в ходе которых может образоваться бензол.
1) дегидрирование циклогексана
2) дегидрирование и циклизация гексана
3) дегидрирование циклопентана
4) дегидрирование гептана
5) дегидрирование бутана
Из предложенного перечня выберите два вещества, с которыми взаимодействует метиламин.
1) водород
3) соляная кислота
2) 2-метилпентан
4) натрий
5) хлорметан
Установите соответствие между названием вещества и названием продукта, который преимущественно образуется при взаимодействии этого вещества с избытком хлороводорода: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) бутен-1
Б) пропин
В) циклопропан
Г) пропен
ПРОДУКТ РЕАКЦИИ
1) 1-хлорбутан
2) 2-хлорбутан
3) 2-хлорпропан
4) 1-хлорпропан
5) 1,2-дихлорпропан
6) 2,2 - дихлорпропан
Установите соответствие между реагирующими веществами и органическим веществом, которое является продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) НСНО 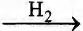
Б) СН3СНО 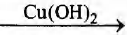
В) C2H5OH 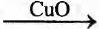
Г) С2Н5ОН 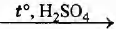
ПРОДУКТ РЕАКЦИИ
1) метанол
2) ацетальдегид
3) уксусная кислота
4) углекислый газ
5) ацетат меди(II)
6) диэтиловый эфир
Задана следующая схема превращений веществ:
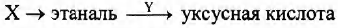
Определите, какие из указанных веществ являются веществами X и Y.
1. этан
2. 1,1-дихлорэтан
3. 1,2-дихлорэтан
4. KMnO4(H+)
5. CuO(t0)
Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие этана и кислорода.
1. эндотермическая
2. окислительно-восстановительная
3. гомогенная
4. реакция соединения
5. обратимая
Выберите те металлы, у которых скорость взаимодействия с водой при комнатной температуре и одинаковой степени измельчения гораздо выше, чем у остальных:
1. Ca
2. Ag
3. Fe
4. Rb
5. Li
Установите соответствие между схемой реакции и изменением степени окисления окислителя в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) H2S + H2O2 → H2SO4 + H2O
Б) Zn + KNO3 + KOH + H2O →K2[Zn(OH)4] + NH3
В) Zn + H2SO4 → ZnSO4 + S + H2O
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
1) 0 → –1
2) –1 → –2
3) +5 → –3
4) +6 → 0
Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) K3PO4
Б) CaCl2
В) CuCl2
Г) Cu(NO3)2
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) H2, O2
2) Cu, O2
3) Cu, Cl2
4) H2, Cl2
5) Cu, NO2

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке убывания значения pH их водных растворов.
1) Фенолят натрия
2) Пропановая кислота
3) Серная кислота
4) Хлорат стронция
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ
A) N2(г) + ЗН2(г) [math]\leftrightarrows[/math] 2NH3(г)
Б) 2Н2(г) + Cl2(г) [math]\leftrightarrows[/math] 2Н2О(г)
B) Н2г + Сl2г [math]\leftrightarrows[/math] 2НСl(г)
Г) SО2Cl2(r) [math]\leftrightarrows[/math] SO2(r) + Сl2(г)
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) смещается в сторону прямой реакции
2) смещается в сторону обратной реакции
3) равновесие практически не смещается
В реактор постоянного объёма поместили оксид серы(VI). При этом его исходная концентрация составляла 0,8 моль/л. В результате протекания обратимой реакции 2SO3 (г.) ⇋ 2SO2 (г.) + O2 (г.) в реакционной системе установилось химическое равновесие, при котором концентрация оксида серы(IV) составила 0,6 моль/л. Определите равновесные концентрации SO3 (X) и O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить их водные растворы: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛЫ ВЕЩЕСТВ
А) HNO3 и H2O
Б) NaCl и KOH
В) KCl и BaBr2
Г) I2 и FeCl3
РЕАГЕНТ
1) Na2CO3
2) HNO3
3) HCl
4) KNO3
5) CuCl2
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) азот
Б) метан
В) изопрен
Г) пропилен
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) получение капрона
2) в качестве топлива
3) получение каучука
4) получение аммиака
5) получение полимеров
Вычислите массу хлорида бария (в граммах), которую следует растворить в 120 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%.
Ответ:____________________г.
(Запишите число с точностью до сотых.)
В результате реакции, термохимическое уравнение которой
2Н2(г) + О2(г) = 2Н2О(г) + 484 кДж,
выделилось 242 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах).
Ответ:____________________г.
(Запишите число с точностью до целых.)
Образец цинка массой 240 г содержит 2,5% примесей хлорида цинка. Определите объём газа (в литрах при н.у.), который выделится при растворении указанного образца в соляной кислоте. (Запишите число с точностью до сотых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Нитрат бария, сульфид калия, соляная кислота, нитрит натрия, перманганат калия, ацетат железа(II). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 8H2O + 5Cl2
2) Указан электронный баланс
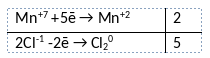
3) Указано, что марганец в степени окисления +7 (перманганат калия) является окислителем, в хлор в степени окисления -1 (соляная кислота) является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции образуется осадок. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
(CH3COO)2Fe + K2S = FeS + 2CH3COOK
2) Написано полное ионное уравнение:
2CH3COO- + Fe2+ + 2K+ + S2- = FeS + 2CH3COO- + 2K+
3) Написано сокращённое ионное уравнение:
Fe2+ + S2- = FeS
Фосфор сожгли в избытке хлора. Полученный продукт обработали избытком раствора едкого кали, а затем — известковым молоком. Выпавший осадок прокалили в электропечи с углём и кварцевым песком. Напишите уравнения четырёх описанных реакций.
1) 2Р + 5Сl2 = 2РСl5
2) РСl5 + 8КОН = К3РO4 + 5КСl + 4Н2O
3) 2К3РO4 + ЗСа(ОН)2 = Ca3(PO4)2↓ + 6КОН
4) Са3(РO4)2 + 5С + 3SiO2 = 3CaSiO3 + 5СО↑ + 2Р↑
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
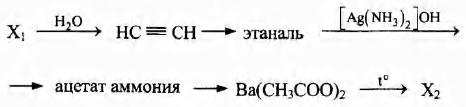
При написании уравнений реакций используйте структурные формулы органических веществ.
1) СаС2 + 2Н2O → Са(ОН)2 + НС [math]\equiv[/math] СН
2) НС [math]\equiv[/math] СН + Н2O → СН3 — С(O)Н
3) СН3—С(O)Н + 2[Ag(NH3)2]OH → СН3—COONH4 + 2Ag + 3NH3 + Н2O
4) 2СН3—COONH4 + Ва(ОН)2 → Ва(СН3СОО)2 + 2NH3 + 2Н2O
5) Ва(СН3СОО)2  ВаСO3 + (СН3)2С = О
ВаСO3 + (СН3)2С = О
При сгорании 8,1 г органического вещества нециклического строения получили 13,44 л (н.у.) углекислого газа и 8,1 г воды. Известно, что данное вещество не реагирует с аммиачным раствором оксида серебра, а 1 моль его в присутствии катализатора присоединяет только 1 моль воды.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу вещества;
3) составьте структурную формулу вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции гидратации этого органического вещества.
2) молекулярная формула вещества С4Н6
3) структурная формула СН3 — С[math]\equiv[/math]С — СН3
4) уравнение реакции
СН3—С[math]\equiv[/math]С—СН3 + Н2O → СН3 — СН2—С(О) — CH3
39,4 г смеси хлорида натрия и безводного сульфата меди (II), содержащей 8,428 · 1023 атомов, растворили в воде. Через полученный раствор массой 200 г пропускали электрический ток до тех пор, пока на аноде не выделилось 3,36 л (при н. у.) газа. К оставшемуся после электролиза раствору прилили 5%-ный раствор гидроксида бария в количестве, необходимом для полного связывания сульфат-ионов. Вычислите массовую долю щелочи в конечном растворе.
Элементы ответа:
Записаны уравнения реакций:
(1) 2NaCl + CuSO4 = Cl2 + Cu + Na2SO4 (можно CuCl2 = Cu + Cl2)
(2) 2NaCl + 2H2O = 2NaOH + Cl2 + H2
(3) Na2SO4 + Ba(OH)2 = 2NaOH + BaSO4
Вычислим количества исходных веществ
n(атомов) = N : NA = 8,428 · 1023 : 6,02 • 1023 = 1,4 моль
Пусть n(NaCl) = x моль, n(CuSO4) = y моль
2x + 6y = 1,4
58,5x + 160y = 39,4
x = 0,4 моль, y = 0,1 моль
n(Cl2) = V : Vm = 3,36 : 22,4 = 0,15 моль
Вычислим количество гидроксида натрия
n1(Cl2) = n(CuSO4) = 0,1 моль < 0,15 моль ⇒ идет электролиз оставшегося NaCl
n2(Cl2) = 0,15 – 0,1 = 0,05 моль
n2(NaOH) = 2n2(Cl2) = 0,1 моль
На этом этапе стоит проверить, что электролизу подвергся не весь оставшийся NaCl и сделать вывод, что «перелета» на воду не было.
n3(NaOH) = 2n(Na2SO4) = 0,2 моль
nобщ.(NaOH) = 0,2 + 0,1 = 0,3 моль
m(итог. р-ра) = 200 – m(Cu) – m(Cl2) – m(H2) + mр-ра(Ba(OH)2) – m(BaSO4)
m(Ba(OH)2) = n • M = 0,1 • 171 = 17,1 г
m(итог. р-ра) = 200 – 0,1 • 64 – 0,15 • 71 – 0,05 • 2 + 17,1 : 0,05 – 0,1 • 233
m(итог. р-ра) = 501,55 г
Вычислим массовую долю гидроксида натрия
m(NaOH) = n • M = 0,3 • 40 = 12 г
ω(NaOH) = 12 : 501,55 • 100% = 2,39%| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||