Вариант 17
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Определите элементы, атомы которых в основном состоянии содержат два неспаренных электрона
1. Mg
2. P
3. N
4. O
5. Ti
Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания их восстановительных свойств.
1) S
2) Cu
3) Cl
4) Si
5) Mg
Из числа указанных в ряду элементов выберите два элемента, проявляющих во всех соединениях только положительную степень окисления.
1) Na
2) Si
3) Mg
4) C
5) O
Из предложенного перечня выберите два вещества с ионной кристаллической решёткой, в которых присутствует ковалентная неполярная химическая связь.
1) силикат кальция
2) пероксид натрия
3) ацетиленид натрия
4) гидроксид бария
5) этиленгликоль
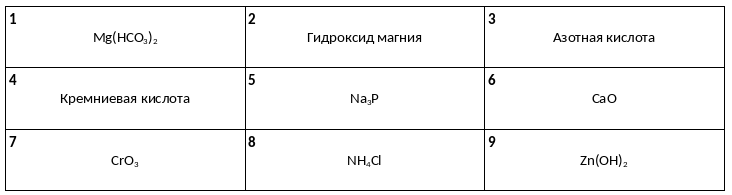
Среди предложенных названий и формул веществ, расположенных в пронумерованных ячейках, выберите названия или формулы: А) кислотного оксида, Б) амфотерного гидроксида, В) двухосновной кислоты.
К одной из пробирок с раствором хлорида меди (II) добавили раствор слабого электролита X, а через другую пропустили газ Y. В результате в первой пробирке наблюдалось выпадение голубого осадка, а во второй – выпадение черного осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) NH3
2) H2S
3) AgNO3
4) NaOH
5) Al(OH)3
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) H2
Б) KOH
В) H2S
Г) H2O
РЕАГЕНТЫ
1) NaOH, CuSO4, SO2
2) S, FeO, Ca
3) NaHCO3, P, Al2O3
4) Al2S3, Ba, PCl5
5) HCl, FeBr2, O2
Установите соответствие между формулой вещества и классом/группой органических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) HCOOH
Б) CH3CH2C(O)CH2CH3
В) CH3CH2OCH3
КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1) спирты
2) кетоны
3) карбоновые кислоты
4) простые эфиры
Установите соответствие между исходными(-ым) веществами(-ом), вступающими(-им) в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
ИСХОДНЫЕ(-ОЕ) ВЕЩЕСТВА(-О)
А) NaHCO3 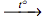
Б) Cl2 и NaOH(t˚)
В) NaHCO3 и HCl
Г) NaHCO3 и NaOH
ПРОДУКТЫ РЕАКЦИИ
1) Na2O2, CO2 и H2O
2) Na2CO3 и H2O
3) NaCl, CO2 и H2O
4) Na2CO3, CO2 и H2O
5) NaCl, NaClO3 и H2O
6) NaCl, NaClO и H2O
Из предложенного перечня выберите два вещества, молекулы которых содержат карбонильную группу.
1) глицерин
2) фруктоза
3) бутанон
4) этиленгликоль
5) анилин
Из предложенного перечня выберите два углеводорода, которые реагируют с аммиачным раствором оксида серебра(I).
1) бутен-2
2) пропин
3) этин
4) бутин-2
5) этен
Из предложенного перечня выберите все вещества, с которыми взаимодействует метановая кислота.
1) CH3–OH
2) NH3
3) NaOH
4) SiO2
5) [Ag(NH3)2]OH
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) С2Н4Cl2 + Zn →
Б) С2Н4 + Н2О (H+) →
В) С2Н4Cl2 + KOH(спирт. р-р) →
Г) С2Н2 + Н2О (Hg2+) →
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) СН2=CH2
2) СН3-СНO
3) HС≡СH
4) CH4
5) СН3-СH3
6) СН3-СН2-OH
Задана схема превращений веществ:
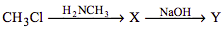
Определите, какие из указанных веществ являются веществами Х и Y.
1) CH2=CHNH2
2) (CH3)2NH2Cl
3) (CH3)2NH
4) CH3CH2NH2
5) CH3CH2NH3Cl
Из предложенного перечня выберите два типа реакций, к которым можно отнести взаимодействие этанола с пропионовой кислотой.
1) присоединения
2) окисления
3) нейтрализации
4) этерификации
5) обратимая
Установите соответствие между реагирующими веществами и органическим веществом – продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CH3COOH и Na
Б) CH3COOH и NH
В) CH3COOH и CH3OH
Г) CH3COOH и NaHCO3
ПРОДУКТ РЕАКЦИИ
1) метилформиат
2) ацетат аммония
3) ацетат натрия
4) метилацетат
5) этилат натрия
6) аминоуксусная кислота
Из предложенного перечня выберите все реакции ионного обмена.
1. CH3OH + HBr = CH3Br + H2O
2. NaCl + AgNO3 = NaNO3 + AgCl
3. CH3COONa + HCl = CH3COOH + NaCl
4. CH3COOCH3 + KOH = CH3COOK + CH3OH
5. Zn + 2HCl = ZnCl2 + H2
Из предложенного перечня внешних воздействий выберите все воздействия, которые не влияют на скорость реакции, протекающей по схеме:
Cu2+ + Zn = Cu + Zn2+
1. Понижение давления
2. Понижение температуры
3. Уменьшение концентрации ионов цинка
4. Добавление металлической меди
5. Добавление воды в реакционную колбу
Установите соответствие между уравнением реакции и изменением степени окисления восстановителя в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ
А) 3СuO + 2NH3 = N2 + 3Cu + 3H2O
Б) 2Pb(NO3)2 = 2PbO + 4NO2 + O2
В) 3NO2 + H2O= 2HNO3 + NO
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
1) –2 → 0
2) –3 → 0
3) +4 → +5
4) +5 → +4
Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества, которые образуются на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Na2CO3
Б) NaCl
В) CH3COONa
Г) NaOH
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) этан, углекислый газ, водород
2) натрий, кислород
3) метан, углекислый газ, водород
4) хлор, водород
5) водород, кислород

Вещества, приведенные в перечне, растворили в воде и получили растворы с одинаковой молярной (моль/л) концентрацией веществ. Определите характер среды полученных растворов. Запишите номера веществ в порядке возрастания значения pH растворов, полученных при внесении данных веществ в воду.
1) (NH4)2SO4
2) H2SO4
3) NaClO
4) LiOH
Установите соответствие между способом воздействия на равновесную систему
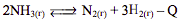
смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВОЗДЕЙСТВИЕ НА СИСТЕМУ
А) увеличение концентрации водорода
Б) добавление катализатора
В) понижение температуры
Г) повышение давления
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) смещается в сторону прямой реакции
2) смещается в сторону обратной реакции
3) практически не смещается
В реактор постоянного объёма поместили некоторое количество оксида азота(IV). В результате протекания обратимой реакции 2NO2 (г.) ⇋ 2NO (г.) + O2 (г.) в реакционной системе установилось химическое равновесие, при котором концентрации оксида азота(IV) и кислорода составили 0,4 моль/л и 0,3 моль/л соответственно. Определите исходную концентрацию NO2 (X) и равновесную концентрацию NO (Y).
Выберите из списка номера правильных ответов.
1) 0,2 моль/л
2) 0,4 моль/л
3) 0,6 моль/л
4) 0,8 моль/л
5) 1,0 моль/л
6) 1,2 моль/л
Установите соответствие между реагирующими веществами и признаком реакции, протекающей между ними: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na2Cr2O7 и LiOH
Б) Mg(HCO3)2 и HNO3
В) MgCl2 и NaOH
Г) K2CrO4 и HNO3
ПРИЗНАК РЕАКЦИИ
1) изменение окраски раствора на оранжевую
2) изменение окраски раствора на жёлтую
3) растворение осадка
4) выделение газа
5) образование белого осадка
Установите соответствие между процессом и аппаратом, в котором этот процесс происходит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОЦЕСС
А) перегонка нефти
Б) получение натрия
В) получение аммиака
АППАРАТ
1) доменная печь
2) колонна синтеза
3) электролизёр
4) ректификационная колонна
К 75 г раствора с массовой долей соли 14% добавили 10 г той же соли и 10 мл воды. Вычислите массовую долю соли в полученном растворе. (Запишите число с точностью до десятых.)
Ответ: _____%.
Определите объём водорода, необходимый для полного гидрирования 50 л ацетилена. Объёмы газов измерены при одинаковых условиях. (Запишите число с точностью до целых.)
Ответ: _____л.
Образец сульфида алюминия массой 500 г с содержанием примесей 10% растворили в избытке гидроксида натрия. Определите массу сульфида натрия (г), который образовался при этом. (Запишите число с точностью до целых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Пероксид водорода, гидроксид железа(III), хлор, сульфит аммония, бром, гидроксид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется соль и кислота, не выделяется осадок и газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
(NH4)2SO3 + Cl2 + H2O = (NH4)2SO4 + 2HCl
2) Указан электронный баланс
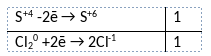
3) Указано, что хлор в степени окисления 0 является окислителем, а сера в степени окисления +4 (сульфит аммония) является восстановителем
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции образуется слабый электролит. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
(NH4)2SO3 + 2NaOH = 2NH3∙H2O + Na2SO3
2) Написано полное ионное уравнение:
2NH4+ + SO32- + 2Na+ + 2OH- = 2NH3∙H2O + 2Na+ + SO32-
3) Написано сокращённое ионное уравнение:
NH4+ + OH- = NH3∙H2O
Через раствор гидроксида натрия пропустили избыток углекислого газа. Полученное при этом вещество выделили из раствора, высушили и прокалили. Образовавшуюся после прокаливания соль растворили в воде и к этому раствору прилили раствор бромида железа(III). Выделившийся при этом осадок отделили и поместили в раствор иодоводородной кислоты. Напишите уравнения четырёх описанных реакций.
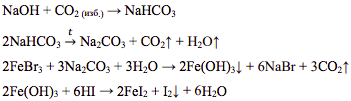
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
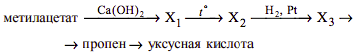
При написании уравнений реакций используйте структурные формулы органических веществ.
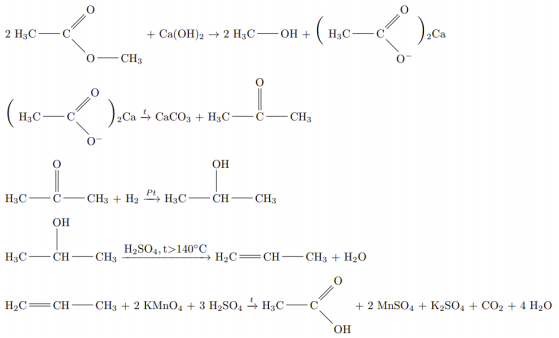
При сгорании органического вещества, не содержащего кислорода, получили 19,8 г углекислого газа, 5,4 г воды и 6,72 л хлороводорода (н.у.). Известно, что это вещество может быть получено взаимодействием соответствующего углеводорода с избытком хлороводорода.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения данного вещества взаимодействием соответствующего углеводорода с избытком хлороводорода (используйте структурную формулу органического вещества).
CxHyClz + (x + 0,25y - 0,25z)O2 → xCO2 + (0,5y - 0,5z)H2O + zHCl
ν(CO2) = m(CO2) : M(CO2) = 19,8 : 44 = 0,45 (моль)
ν(HCl) = V(HCl) : VM = 6,72 : 22,4 = 0,3 (моль)
ν(H2O) = m(H2O) : M(H2O) = 5,4 : 18 = 0,3 (моль)
ν(C) = 0,45 (моль)
ν(Cl) = 0,3 (моль)
ν(H) = 2 · ν(H2O) + ν(HCl) = 2 · 0,3 + 0,3 = 0,9 (моль)
x : y : z = 0,45 : 0,9 : 0,3 = 1,5 : 3 : 1 = 3 : 6 : 2
Молекулярная формула C3H6Cl2.
Структурная формула H3C-CCl2-CH3.
Уравнение реакции:
HC≡C-CH3 + 2HCl → H3C-CCl2-CH3
Также возможна реакция:
H2C=C=CH2 + 2HCl → H3C-CCl2-CH3
Растворимость хлороводорода 448 л (н.у.) на 1 л воды. Растворимость аммиака 640 л (н.у.) на литр воды. Смешали насыщенные растворы аммиака и хлороводорода, все вещества прореагировали полностью. Затем добавили раствор нитрата серебра, образовался раствор 640 г с массовой долей единственно растворённого вещества 25%. Вычислите массовую долю нитрата серебра в добавленном растворе.
Элементы ответа:
Записаны уравнения реакций:
[1] NH3 + HCl ⟶ NH4Cl
[2] AgNO3 + NH4Cl ⟶ AgCl + NH4NO3
2. Найдем число моль нитрата аммония в конечном растворе:
m NH4NO3 = mконечн. р-ра · ω NH4NO3 = 640 · 0,25 = 160 г
n NH4NO3 = m NH4NO3 / M NH4NO3 = 160 / 80 = 2 моль
3. Найдем объем аммиака и хлороводорода:
n NH4Cl = n NH4NO3 = 2 моль
n NH3 = n HCl = n NH4Cl = 2 моль
V NH3 = n NH3 · Vm = 2 · 22,4 = 44,8 л
V HCl = n HCl · Vm = 2 · 22,4 = 44,8 л
4. Найдем массы растворов аммиака и хлороводорода:
Пусть V H2O в растворе аммиака = x г, тогда
640 / 1 = 44,8 / x
x = 0,07
V H2O = 0,07 л = 70 мл
m H2O = V H2O · p H2O = 70 · 1 = 70 г
mр-ра NH3 = m H2O + n NH3 · M NH3 = 70 + 2 · 17 = 104 г
Пусть V H2O в растворе хлороводорода = y г, тогда
448 / 1 = 44,8 / y
y = 0,1
V H2O = 0,1 л = 100 мл
m H2O = V H2O · p H2O = 100 · 1 = 100 г
mр-ра HCl = m H2O + n HCl · M HCl = 100 + 2 · 36,5 = 173 г
5. Найдем массу раствора нитрата серебра(I):
mконечн. р-ра = mр-ра NH3 + mр-ра HCl + mр-ра AgNO3 – m AgCl = 640 г
n AgCl = n NH4NO3 = 2 моль
m AgCl = n AgCl · M AgCl = 2 · 143,5 = 287 г
mр-ра AgNO3 = mконечн. р-ра – mр-ра NH3 – mр-ра HCl + m AgCl = 640 – 104 – 173 + 287 = 650 г
6. Найдем массовую долю нитрата серебра(I) в добавленном растворе:
n AgNO3 = n NH4NO3 = 2 моль
m AgNO3 = n AgNO3 · M AgNO3 = 2 · 170 = 340 г
ω AgNO3 = m AgNO3 / mр-ра AgNO3 = 340 / 650 = 0,5231 → 52,31%
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||