Вариант 16
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат один неспаренный электрон. Запишите в поле ответа два номера выбранных элементов.
1) S
2) Na
3) Al
4) Si
5) Mg
Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания их восстановительных свойств.
1) Cr
2) P
3) Na
4) Si
5) N
Из указанных в ряду элементов выберите два элемента, которые в соединении с водородом проявляют отрицательную степень окисления.
1) Al
2) Na
3) C
4) Mg
5) S
Из предложенного перечня выберите два вещества немолекулярного строения, в которых представлена ковалентная полярная связь.
1) диметиламин
2) бензойная кислота
3) сульфид калия
4) нитрат аммония
5) формиат кальция
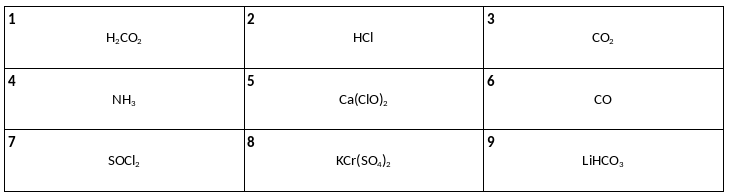
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) кислотного оксида, Б) средней соли, В) сильной кислоты.
К одной из пробирок с раствором сульфида натрия добавили раствор вещества X, а к другой – раствор вещества Y. В результате в первой пробирке наблюдалось только выделение газа, а во второй – выпадение черного осадка. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) AlCl3
2) AgNO3
3) ZnSO4
4) HCl
5) NH4Cl
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) KI
Б) HNO3 (конц.)
В) Al(OH)3
Г) O2
РЕАГЕНТЫ1) PH3, Si, H2
2) Fe3O4, Cl2, HF
3) Mg(HCO3)2, P, CuO
4) KMnO4, AgNO3, H2O2
5) H2SO4, NaOH, Ba(OH)2
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Cu(NO3)2
Б) Al(OH)3
В) ZnCl2
Г) Cu
РЕАГЕНТЫ
1) NaOH, Mg, Ba(OH)2
2) HCl, LiOH, H2SO4 (р-р)
3) BaCl2, Pb(NO3)2, S
4) CH3COOH, KOH, FeS
5) O2, Br2, HNO3
В заданной схеме превращений
Cu —X—> CuCl2 —Y—>CuI
веществами Х и Y являются:
1) AgI
2) I2
3) Cl2
4) HCl
5) KI
Установите соответствие между общей формулой гомологического ряда и названием вещества, принадлежащего к этому ряду: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ОБЩАЯ ФОРМУЛА
А) CnH2n+2O
Б) CnH2nO2
В) CnH2n+2O2
НАЗВАНИЕ ВЕЩЕСТВА
1) этиленгликоль
2) пропанол
3) муравьиная кислота
4) глицерин
Из предложенного перечня веществ выберите два вещества, которые являются изомерами циклопентана.
1. 2-метилбутан
2. 1,2-диметилциклопропан
3. пентен-2
4. гексен-2
5. циклопентен
Из предложенного перечня выберите все вещества, с которыми взаимодействует пропановая кислота.
1) гидросульфат натрия
2) гидрокарбонат аммония
3) этилбензол
4) этанол
5) кальций
Из предложенного перечня веществ выберите два вещества, которые подвергаются гидролизу.
1. глюкоза
2. сахароза
3. фруктоза
4. рибоза
5. крахмал
Установите соответствие между названием исходного вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с бромом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ИСХОДНОГО ВЕЩЕСТВА
А) пропан
Б) циклогексан
В) циклопропан
Г) изобутан
ПРОДУКТ БРОМИРОВАНИЯ
1) 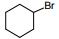
2) 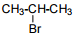
3) 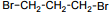
4) 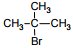
5) 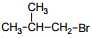
6) 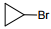
Установите соответствие между схемой реакции и органическим веществом, которое является продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) CH3CHO → Cu(OH)2
Б) CH3CHO →H2
В) CH3CH2OH→CuO
Г) CH3CH2OH →H2SO4 t
ПРОДУКТ РЕАКЦИИ
1) этанол
2) ацетат калия
3) ацетальдегид
4) диэтиловый эфир
5) ацетат меди(II)
6) этановая кислота
Задана следующая схема превращений веществ:
1,2-дибромэтан → X → бромэтан → Y → этилформиат
Определите, какие из указанных веществ являются веществами Х и Y.
1. этанол
2. этаналь
3. этилен
4. хлорэтан
5. ацетилен
Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие оксида меди (II) и водорода.
1. реакция соединения
2. реакция замещения
3. гетерогенная
4. окислительно-восстановительная
5. обратимая
Из предложенного перечня реакций выберите все реакции, скорость которых зависит как от концентрации кислоты, так и от площади поверхности соприкосновения реагентов:
1. NO2 (г) + O2 (г) + H2O (ж) = HNO3 (р-р)
2. AgNO3 (р-р) + HCl (р-р) = AgCl (тв) + HNO3 (р-р)
3. Zn (тв) + 2HCl (р-р) = ZnCl2 (р-р) + H2
4. CaCO3 (тв) + 2HNO3 (р-р) = Ca(NO3)2 (р-р) + H2O (ж) + CO2 (г)
5. SO3 (г) + H2O (ж) = H2SO4 (р-р)
Установите соответствие между схемой реакции и свойством элемента железо, которое этот элемент проявляет в данной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) FeCl3 + Na2CO3 + H2O → Fe(OH)3 + NaCl + CO2
Б) FeO →Fe3O4 + Fe
В) Fe + HNO3 → Fe(NO3)3 + NO2 + H2O
СВОЙСТВО ЖЕЛЕЗА
1) только окислитель
2) только восстановитель
3) и окислитель, и восстановитель
4) не проявляет окислительно-восстановительных свойств
Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) NaBr
Б) Mg(NO3)2
В) AlCl3
Г) CuSO4
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) кислород и металл
2) водород и кислород
3) галоген и металл
4) водород и сера
5) водород и галоген

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке возрастания значения pH их водных растворов.
1) Сульфат цинка
2) Карбонат натрия
3) Серная кислота
4) Хлорат стронция
Установите соответствие между способом воздействия на равновесную систему
СO(г) + Cl2(г) 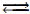 COCl2(г) + Q
COCl2(г) + Q
и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВОЗДЕЙСТВИЕ НА СИСТЕМУ
А) увеличение концентрации оксида углерода(II)
Б) повышение температуры
В) понижение давления
Г) увеличение концентрации хлора
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) смещается в сторону обратной реакции
2) практически не смещается
3) смещается в сторону прямой реакции
В реактор постоянного объёма поместили оксид азота(IV). При этом его исходная концентрация составляла 1,4 моль/л. В результате протекания обратимой реакции 2NO2 (г.) ⇋ 2NO (г.) + O2 (г.) в реакционной системе установилось химическое равновесие, при котором концентрация оксида азота(II) составила 0,8 моль/л. Определите равновесные концентрации NO2 (X) и O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,2 моль/л
2) 0,4 моль/л
3) 0,6 моль/л
4) 0,8 моль/л
5) 1,0 моль/л
6) 1,2 моль/л
Установите соответствие между двумя веществами и реагентом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВА
А) FeSO4 и FeCl2
Б) Na3PO4 и Na2SO4
В) KOH и Ca(OH)2
Г) KОН и KCl
РЕАГЕНТ
1) NH3 (р-р)
2) NaOH
3) Ba(NO3)2
4) MgCl2
5) Na2CO3
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) аммиак
Б) тетрахлорид углерода
В) ацетон
Г) этилен
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) получение высокомолекулярных соединений
2) производство удобрений
3) в качестве растворителя
4) получение капрона
5) в качестве топлива
Какую массу гидроксида калия необходимо растворить в 150 г воды для получения раствора с массовой долей щёлочи 25%? (Запишите число с точностью до целых.)
Ответ: __________ г.
В реакцию, термохимическое уравнение которой
MgO(тв.) + CO2(г) → MgCO3(тв.) + 102 кДж,
вступило 88 г углекислого газа. Какое количество теплоты выделится при этом? (Запишите число с точностью до целых.)
Ответ: _____________ кДж.
На взаимодействие с 2,5 кг технического карбоната натрия потребовалась соляная кислота, содержащая 1,46 кг хлороводорода. Вычислите массовую долю (%) нерастворимых в кислоте примесей в образце технического карбоната натрия. (Запишите число с точностью до десятых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Иодид калия, ацетат натрия, серная кислота, нитрат стронция, нитрат меди(II), перманганат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. Реакция протекает с изменением цвета раствора, выделяется газ с неприятным запахом. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
8KI + 9H2SO4 = 8KHSO4 + 4I2 + H2S + 4H2O
2) Указан электронный баланс
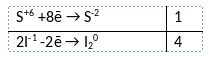
3) Указано, что сера в степени окисления +6 (серная кислота) является окислителем, а иод в степени окисления -1 (иодид калия) является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции выпадает осадок. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
Sr(NO3)2 + H2SO4 = SrSO4 + 2HNO3
2) Написано полное ионное уравнение:
Sr2+ + 2NO3- + 2H+ + SO42- = SrSO4 + 2H+ + 2NO3-
3) Написано сокращённое ионное уравнение:
Sr2+ + SO42- = SrSO4
Смесь газов, полученную при прокаливании нитрата меди(II), поглотили водой, при этом образовалась кислота. Фосфид кальция обработали водой, при этом выделился газ. Этот газ осторожно пропустили через горячий концентрированный раствор полученной кислоты. Напишите уравнения четырёх описанных реакций.
2Cu(NO3)2 = 2CuO + 4NO2 + O2
4NO2 + O2 + 2H2O = 4HNO3
Ca3P2 + 6H2O = 2PH3 + 3Ca(OH)2
PH3 + 8HNO3 = 8NO2 + 4H2O + H3PO4
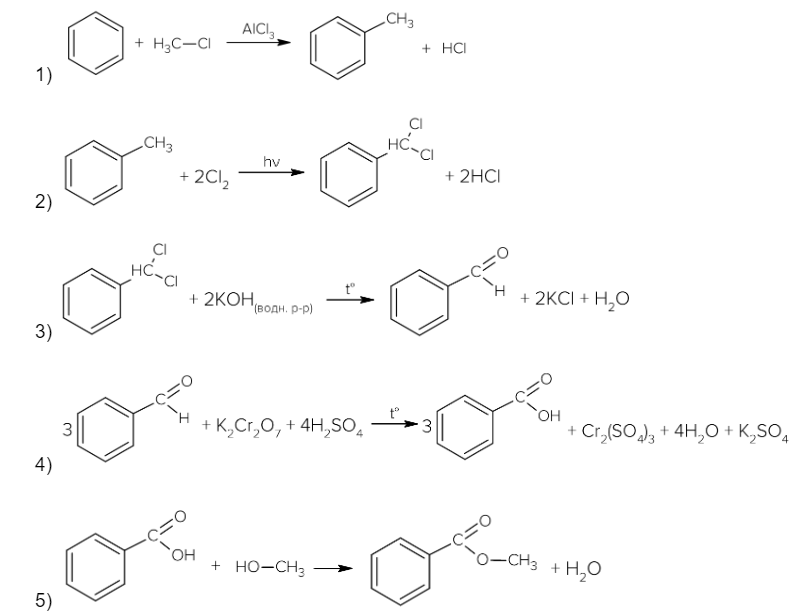
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
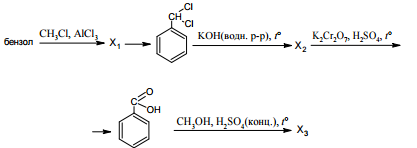
При написании уравнений реакций используйте структурные формулы органических веществ.
При сгорании 16,2 г органического вещества нециклического строения получили 26,88 л (н.у.) углекислого газа и 16,2 г воды. Известно, что 1 моль этого органического вещества в присутствии катализатора присоединяет только 1 моль воды и данное вещество не реагирует с аммиачным раствором оксида серебра.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции гидратации органического вещества
1) Проведены вычисления:
n(СO2) = 26,88 / 22,4 = 1,2 моль; n(C) = 1,2 моль
n(Н2O) = 16,2 /18 = 0,9 моль; n(H) = 1,8 моль
m(O) = 16,2 – 1,2*12 – 1,8*1 = 0
Органическое вещество не содержит кислорода.
2) Определена молекулярная формула органического вещества: С4H6
3) Составлена структурная формула вещества:
Н3С–С≡С–СН3
4) написано уравнение реакции гидратации органического вещества:
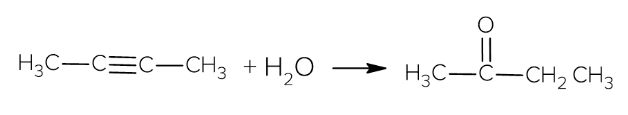
Растворимость бромоводорода 560 л (н.у.) на 1 л воды. Растворимость аммиака 640 л (н.у.) на литр воды. Смешали насыщенные растворы аммиака и бромоводорода, все вещества прореагировали полностью. Затем добавили раствор нитрата серебра, образовался раствор 1000 г с массовой долей единственно растворённого вещества 24%. Вычислите массовую долю нитрата серебра в добавленном растворе.
Элементы ответа:
Записаны уравнения реакций:
[1] NH3 + HBr ⟶ NH4Br
[2] AgNO3 + NH4Br ⟶ AgBr + NH4NO3
2. Найдем число моль нитрата аммония в конечном растворе:
m NH4NO3 = mконечн. р-ра · ω NH4NO3 = 1000 · 0,24 = 240 г
n NH4NO3 = m NH4NO3 / M NH4NO3 = 240 / 80 = 3 моль
3. Найдем объем аммиака и бромоводорода:
n NH4Br = n NH4NO3 = 3 моль
n NH3 = n HBr = n NH4Br = 3 моль
V NH3 = n NH3 · Vm = 3 · 22,4 = 67,2 л
V HBr = n HBr · Vm = 3 · 22,4 = 67,2 л
4. Найдем массы растворов аммиака и бромоводорода:
Пусть V H2O в растворе аммиака = x г, тогда
640 / 1 = 67,2 / x
x = 0,105
V H2O = 0,105 л = 105 мл
m H2O = V H2O · p H2O = 105 · 1 = 105 г
mр-ра NH3 = m H2O + n NH3 · M NH3 = 105 + 3 · 17 = 156 г
Пусть V H2O в растворе бромоводорода = y г, тогда
560 / 1 = 67,2 / y
y = 0,12
V H2O = 0,12 л = 120 мл
m H2O = V H2O · p H2O = 120 · 1 = 120 г
mр-ра HBr = m H2O + n HBr · M HBr = 120 + 3 · 81 = 363 г
5. Найдем массу раствора нитрата серебра(I):
mконечн. р-ра = mр-ра NH3 + mр-ра HBr + mр-ра AgNO3 – m AgBr = 1000 г
n AgBr = n NH4NO3 = 3 моль
m AgBr = n AgBr · M AgBr = 3 · 188 = 564 г
mр-ра AgNO3 = mконечн. р-ра – mр-ра NH3 – mр-ра HBr + m AgBr = 1000 – 156 – 363 + 564 = 1045 г
6. Найдем массовую долю нитрата серебра(I) в добавленном растворе:
n AgNO3 = n NH4NO3 = 3 моль
m AgNO3 = n AgNO3 · M AgNO3 = 3 · 170 = 510 г
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||