Вариант 15
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
1) S
2) Zn
3) O
4) Ва
5) Se
Определите, атомы каких из указанных в ряду элементов не содержат неспаренных электронов. Запишите в поле ответа номера выбранных элементов.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке ослабевания кислотных свойств их высших гидроксидов.
1) Cl
2) Сa
3) Mg
4) Al
5) Mn
Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять валентность I.
1) S
2) Cu
3) Cl
4) Si
5) Mg
Из предложенного перечня выберите два вещества с атомной кристаллической решёткой, в которых присутствует ковалентная полярная химическая связь.
1) кремнезём
2) кремний
3) хлорид кремния
4) карбид кремния
5) графит
Среди предложенных названий и формул веществ, расположенных в пронумерованных ячейках, выберите названия или формулы: А) кислотного оксида, Б) нерастворимой соли, В) одноосновной кислоты.
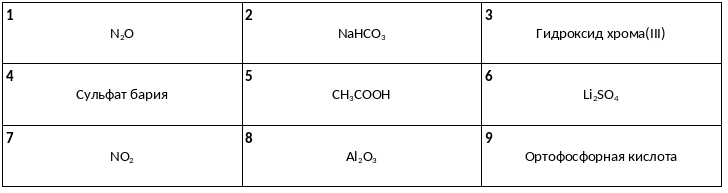
Даны две пробирки с раствором сильного электролита Х. В одну из них добавили раствор фосфата калия, а в другую — раствор соли У. При этом в каждой пробирке наблюдали выпадение белого осадка. Из предложенного перечня выберите вещества Х и Y, которые могут вступать в описанные реакции.
1) K2SO4
2) Li2SO4
3) Cu(OH)2
4) Na2SiO3
5) FeCO3
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) BaBr2
Б) ZnO
В) KOH
Г) SO2
РЕАГЕНТЫ
1) CaCO3, H2SO4, CO
2) P2O5, H2SO4, KCl
3) Cl2, AgNO3, H2SO4
4) O2, Na2SiO3 (р-р), MgO
5) Al(OH)3, NaOH, CaCl2
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Li
Б) SO2
В) Zn(OH)2
Г) ZnBr2
РЕАГЕНТЫ
1) СаО,O2, КОН
2) Cl2, Na2CO3, LiOH
3) K2SO4, Р2O5, HNO3
4) Ва(ОН)2, КОН2, НСl
5) H2SO4, С2Н5ОН, N2
Задана следующая схема превращений веществ:
[math]SiO_2\xrightarrow XK_2SiO_3\xrightarrow YBaSiO_3[/math]
Определите, какие из указанных веществ являются веществами X и Y.
1. H2O
2. BaCl2
3. KCl
4. BaSO4
5. K2O
Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) нитроглицерин
Б) глицерин
В) аланин
КЛАСС/ГРУППА
1) спирт
2) аминокислота
3) сложный эфир
4) нитросоединение
Изомерами пентина-1 являются
1. пентен-1
2. циклопентан
3. пентадиен-1,3
4. изопрен
5. дивинил
Из предложенного перечня выберите схемы всех реакций, в результате которых образуются сложные эфиры

Из предложенного перечня выберите два вещества, которые являются менее сильным основанием, чем аммиак.
1. анилин
2. метиламин
3. диметиламин
4. дифениламин
5. метилэтиламин
Установите соответствие между схемой процесса и стадией цепной реакции, на которой происходит этот процесс. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА ПРОЦЕССА
А) СН4 + Сl• → СН3• + НСl
Б) •CH3 + •СН3 → СН3-СН3
В) Сl2 → 2Сl•
Г) •CCl3 + Cl• → ССl4
СТАДИЯ ЦЕПНОЙ РЕАКЦИИ
1) зарождение цепи
2) развитие цепи
3) обрыв цепи
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) уксусная кислота и гидросульфит натрия
Б) этиловый спирт и натрий
В) муравьиная кислота и оксид натрия
Г) этаналь и водород
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) ацетат натрия
2) этилат натрия
3) этанол
4) формиат натрия
5) уксусная кислота
6) углекислый газ
Задана следующая схема превращений веществ:
[math]C_2H_6\xrightarrow XC_2H_5Br\xrightarrow YC_2H_4[/math]
Определите, какие из указанных веществ являются веществами X и Y.
1. КОН (спирт.)
2. H2O
3. Br2
4. NaOH (водн.)
5. HBr
Из предложенного перечня выберите все типы реакций, в результате которых может образоваться простое вещество.
1. замещения
2. электролиза
3. разложения
4. соединения
5. ионного обмена
Выберите все воздействия, которые позволят повысить скорость реакции, протекающей согласно уравнению:
2H2S (г) + 3O2 (г) = 2SO2 (г) + 2H2O (г) + Q
1. Повышение концентрации сернистого газа
2. Повышение концентрации кислорода
3. Нагревание реакционной смеси
4. Уменьшение объема реакционного сосуда
5. Введение осушителя
Установите соответствие между схемой реакции и свойством элемента фосфор, которое этот элемент проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) PH3 + O2 → H3PO4
Б) H3PO4 + Mg → Mg(H2PO4)2 + H2
В) Mg3P2 + HCl → MgCl2 + PH3
СВОЙСТВО ФОСФОРА
1) только окислитель
2) только восстановитель
3) и окислитель, и восстановитель
4) не проявляет окислительно-восстановительных свойств
Установите соответствие между формулой соли и продуктами электролиза её водного раствора, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) Al2(SO4)3
Б) MgCl2
В) Cu(NO3)2
Г) CuCl2
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) водород и кислород
2) металл и кислород
3) водород и галоген
4) металл и галоген
5) металл и водород

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке возрастания значения pH их водных растворов.
1) Нитрат аммония
2) Нитрит бария
3) Нитрат кальция
4) Гидроксид азота(V)
Установите соответствие между уравнением обратимой химической реакции и одновременным изменением внешних условий, приводящих к смещению химического равновесия в сторону продуктов реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ
А) N2(г) + 3H2(г) [math]\rightleftarrows[/math] 2NH3(г) + Q
Б) N2O4(ж) [math]\rightleftarrows[/math] 2NO2(г) - Q
В) CO2(г) + C(тв.) [math]\rightleftarrows[/math] 2CO(г) + Q
Г) 4HCl(г) + O2 [math]\rightleftarrows[/math] 2H2O(г) + 2Cl2(г) + Q
ИЗМЕНЕНИЕ УСЛОВИЙ
1) увеличение температуры и давления
2) уменьшение температуры и давления
3) увеличение температуры и уменьшение давления
4) уменьшение температуры и увеличение давления
В реактор постоянного объёма поместили оксид азота(II) и кислород. При этом исходная концентрация кислорода составляла 0,20 моль/л. В результате протекания обратимой реакции 2NO (г.) + O2 (г.) ⇋ 2NO2 (г.) в реакционной системе установилось химическое равновесие, при котором концентрации оксида азота(II) и оксида азота(IV) составили 0,05 моль/л и 0,20 моль/л соответственно. Определите исходную концентрацию NO (X) и равновесную концентрацию O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,05 моль/л
2) 0,10 моль/л
3) 0,15 моль/л
4) 0,20 моль/л
5) 0,25 моль/л
6) 0,30 моль/л
Установите соответствие между веществами и реагентом, с помощью которого их можно отличить друг от друга.
ВЕЩЕСТВА
А) BaSO4 и Са3(РO4)2
Б) ВаСl2 и MgCl2
В) AgNO3 и KNO3
Г) Na2O и MgO
РЕАГЕНТ
1) H2SO4(paзб.)
2) НСl(разб.)
3) H2O
4) NaNO3
5) HNO3(конц.)
Установите соответствие между аппаратом химической промышленности и процессом, протекающем в этом аппарате: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
АППАРАТ
А) ректификационная колонна
Б) колонна синтеза
В) контактный аппарат
Г) поглотительная башня
ПРОЦЕСС
1) синтез метанола
2) перегонка нефти
3) окисление сернистого газа
4) взаимодействие оксида серы(VI) с серной кислотой
5) очистка сернистого газа
К 280 г раствора с массовой долей бромида аммония 12% добавили 40 мл воды и 28 г этой же соли. Чему равна массовая доля соли в полученном растворе? (Запишите число с точностью до десятых.)
Ответ: _____________%
Согласно термохимическому уравнению реакции горения метана
СH4(г) + 2O2(г) = СO2(г) + 2Н2O(г) + 880 кДж
выделилось 2200 кДж теплоты. Определите количество вещества сгоревшего при этом метана. (Запишите число с точностью до десятых.)
Ответ: ______________моль
При нагревании 61 г хлората калия в присутствии катализатора было получено 13,44 л (н.у.) кислорода. Определите выход газа (%) в указанной реакции. (Запишите число с точностью до целых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Перманганат натрия, нитрит натрия, гидроксид натрия, гидрокарбонат бария, серная кислота, гидрокарбонат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется зеленый раствор, не образуется осадок. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
NaNO2 + 2NaMnO4 + 2NaOH = NaNO3 + 2Na2MnO4 + H2O
2) Указан электронный баланс
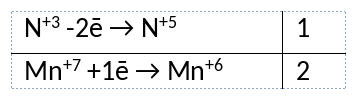
3) Указано, что марганец в степени окисления +7 (перманганат натрия) является окислителем, а азот в степени окисления +3 (нитрит натрия) является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции выделяется газ, но не образуется осадок. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
Mg(HCO3)2 + H2SO4 = MgSO4 + 2CO2 + 2H2O
2) Написано полное ионное уравнение:
Mg2+ + 2HCO3- + 2H+ + SO42- = Mg2+ + SO42- + 2CO2 + 2H2O
3) Написано сокращённое ионное уравнение:
HCO3 - + H+ = CO2 + H2O
Натрий сожгли на воздухе. Образовавшееся вещество обработали концентрированной соляной кислотой. Полученное простое вещество при нагревании вступило в реакцию с оксидом хрома(III) в присутствии гидроксида калия. При обработке раствора одной из образовавшихся солей хлоридом бария выпал жёлтый осадок. Напишите уравнения четырёх описанных реакций.
1) 2Na + O2 = Na2O2
2) Na2O2 + 4HCl = 2NaCl + Cl2 + 2H2O
3) Cr2O3 + 3Cl2 + 10КОН [math]\xrightarrow{t^\circ}[/math] 2К2СrO4 + 6КСl + 5H2O
4) К2СrO4 + BaCl2 = ВаСrO4↓ + 2КСl
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
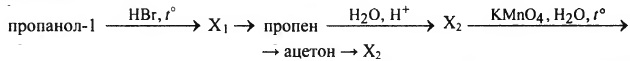
При написании уравнений реакций используйте структурные формулы органических веществ.
1) CH3-CH2-CH2-OH + HBr — CH3-CH2-CH2-Br + H2O
2) CH3-CH2-CH2-Br + КОН(спирт.) [math]\xrightarrow{t^\circ}[/math] CH3-CH=CH2 + H2O + KBr
3) CH3-CH=CH2 + H2O[math]\xrightarrow{H^+}[/math] CH3-CH(OH)-CH3
4) 3CH3-CH(OH)-CH3 + 2KMnO4 [math]\xrightarrow{t^\circ}[/math] 3CH3-CO-CH3 + 2MnO2 + 2KOH + 2H2O
5) CH3-CO-CH3 + H2 [math]\rightarrow[/math] CH3-CH(OH)-CH3
Некоторое органическое соединение содержит 69,6% кислорода по массе. Молярная масса этого соединения в 1,586 раза больше молярной массы воздуха. Известно также, что это вещество способно вступать в реакцию этерификации с пропанолом-2.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с пропанолом-2.
1) Определено число атомов углерода, водорода и кислорода в соединении СxНуОz
M(CxHyOz) = 1,58621 • 29 = 46 г/моль
w(O) = 16 • z / 46 = 0,697
z = 2
M(CxHy) = 46 - 16 • 2 = 46 - 32 = 14 г/моль
x = 1
y = 2
2) Определена молекулярная формула вещества: СН2O2.
3) Составлена структурная формула вещества:
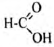
4) Составлено уравнение реакции с пропанолом-2:
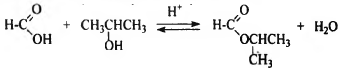
Нитрат стронция медленно нагрели, при этом образовался твёрдый остаток, состоящий из смеси оксида стронция и нитрата стронция, и выделилась смесь газов. Смесь газов пропустили через 400 г 20%-ного раствора гидроксида натрия, при этом массовая доля гидроксида натрия в растворе уменьшилась в 4 раза, а объём непрореагировавшего газа оказался в 6 раз меньше объёма исходной смеси газов. Вычислите массу исходного нитрата стронция.
Элементы ответа:
Записаны уравнения реакций:
(1) Sr(NO3)2 → Sr(NO2)2 + O2
(2) Sr(NO3)2 → 2SrO + 4NO2 + O2
(3) 4NaOH + 4NO2 + O2 → 4NaNO3 + 2H2O
2. Найдем число моль гидроксида натрия в растворе:
m NaOH = mр-ра NaOH · ω NaOH = 400 · 0,2 = 80 г
n NaOH = m NaOH / M NaOH = 80 / 40 = 2 моль
3. Найдем оставшуюся массовую долю гидроксида натрия:
ωост. NaOH = ω NaOH / 4 = 20 / 4 = 5%
4. Найдем число моль нитрата стронция:
Пусть n1 Sr(NO3)2 = x моль, тогда n1 O2 = x моль;
Пусть n2 Sr(NO3)2 = y моль, тогда n NO2 = 2y моль, а n O2 = 0,5y моль
По условию массовая доля щелочи уменьшилась в 4 раза, значит, NaOH в реакции 3 взят в избытке.
Если бы в реакции 3 в недостатке был O2, то NO2 вступил бы в реакцию с NaOH с образованием нитрата и нитрита. Значит, O2 в недостатке быть не может.
Таким образом, в реакции 3 в недостатке взят NO2, а оставшимся после завершения реакции газом является O2
nпрореаг. NaOH = n NO2 = 2y моль
nост. NaOH = n NaOH – nпрореаг. NaOH = (2 – 2y) моль
mост. NaOH = nост. NaOH · M NaOH = (2 – 2y) · 40 = (80 – 80y) г
n3 O2 = n NO2 / 4 = 2y / 4 = 0,5y моль
m3 O2 = n3 O2 · M O2 = 0,5y · 32 = 16y г
m NO2 = n NO2 · M NO2 = 2y · 46 = 92y г
mконечн. р-ра = mр-ра NaOH + m NO2 + m3 O2 = 400 + 92y + 16y = (400 + 108y) г
ωост. NaOH = mост. NaOH / mконечн. р-ра
0,05 = (80 – 80y) / (400 + 108y)
y = 0,7 моль
n2 Sr(NO3)2 = 0,7 моль
n NO2 = 2y = 2 · 0,7 = 1,4 моль
В реакции 2 образуются NO2 и O2 в соотношении 4 к 1. Оксид азота(IV) образуется только в реакции 2 и полностью вступает в реакцию 3, так как находится в недостатке.
Так как соотношение газов в реакции 3 такое же, как и в реакции 2, то число моль кислорода, вступившего в реакцию 3 равно числу моль кислорода, образовавшегося в реакции 2 (n2 O2 = n3 O2)
n2 O2 = n3 O2 = 0,5y = 0,35 моль
V NO2 = n NO2 · Vm = 1,4 · 22,4 = 31,36 л
V3 O2 = n3 O2 · Vm = 0,35 · 22,4 = 7,84 л
Vсмеси = (n NO2 + n1 O2 + n2 O2) · Vm = (1,75 + x) · 22,4 = (39,2 + 22,4x) л
Vобраз. = Vсмеси – V NO2 – V3 O2 = 39,2 + 22,4x – 31,36 – 7,84 = 22,4x л
Vобраз. / Vсмеси = 1 / 6
(22,4x) / (39,2 + 22,4x) = 1 / 6
6x = 1,75 + x
x = 0,35
n1 Sr(NO3)2 = 0,35 моль
n Sr(NO3)2 = n1 Sr(NO3)2 + n2 Sr(NO3)2 = 0,35 + 0,7 = 1,05 моль
5. Найдем массу нитрата стронция:
m Sr(NO3)2 = n Sr(NO3)2 · M Sr(NO3)2 = 1,05 · 212 = 222,6 г
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||