Вариант 13
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
1) Na
2) К
3) F
4) Li
5) Cl
Определите, одновалентные ионы каких из указанных в ряду элементов имеют конфигурацию внешнего электронного слоя 2s22p6. Запишите в поле ответа номера выбранных элементов.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения кислотных свойств соответствующих им высших гидроксидов.
1) Be
2) Si
3) He
4) S
5) Mg
Из указанных в ряду элементов выберите два элемента, которые могут проявлять валентность, равную номеру группы.
1) Ne
2) Be
3) N
4) C
5) O
Из предложенного перечня выберите два вещества молекулярного строения, в которых присутствуют ковалентные полярные связи.
1) SiO2
2) H2SO4
3) CH3OH
4) Cl2
5) NH4NO3
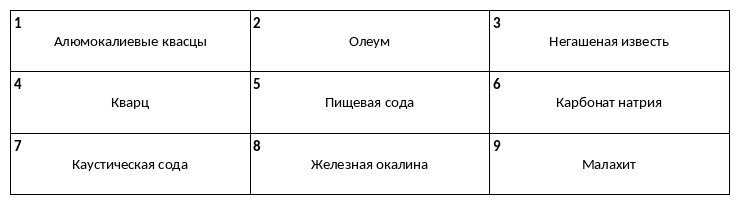
Среди предложенных названий веществ, расположенных в пронумерованных ячейках, выберите названия: А) кислой соли, Б) средней соли, В) двойной соли.
Даны две пробирки с раствором вещества Х. В одну из них добавили раствор гидроксида калия, в другую — раствор слабого электролита Y. При этом в каждой пробирке наблюдали образование осадка. Из предложенного перечня выберите вещества Х и Y, которые могут вступать в описанные реакции.
1) KF
2) NaHCO3
3) NH3∙Н2О
4) Fe2(SO4)3
5) Mg3(PO4)2
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Cu
Б) S
В) Na2O
Г) H2
РЕАГЕНТЫ
1) O2, KOH, HNO3
2) FeO, BaSO4, O2
3) HCl, CO, Br2
4) FeCl3, Cl2, HNO3
5) H2O, ZnO, NO2
Установите соответствие между простыми веществами и формулами реагентов, с которыми они могут взаимодействовать.
ПРОСТОЕ ВЕЩЕСТВО
А) Al
Б) Br2
В) S
Г) H2
ФОРМУЛЫ РЕАГЕНТОВ
1) H2SO4(paзб.), Р
2) Н3РO4, СН4
3) С2Н4, O2
4) Сu, N2
5) O2, Аl
6) KI, Сl2
Задана следующая схема превращений веществ:
[math]Fe\xrightarrow XFe(NO_3)_2\xrightarrow YFe(NO_3)_3[/math]
Определите, какие из указанных веществ являются веществами X и Y.
1. HNO3 (конц.)
2. Cu(NO3)2
3. KNO3
4. NH3
5. Al(NO3)3
Установите соответствие между формулой углеводорода и его названием.
ФОРМУЛА УГЛЕВОДОРОДА
А) С2Н4
Б) С8Н8
В) С3Н6
Г) С3Н4
НАЗВАНИЕ СОЕДИНЕНИЯ
1) этан
2) бензол
3) стирол
4) этен
5) циклопропан
6) пропадиен
Из предложенного перечня выберите два вещества, которые являются гомологами.
1. бензол
2. стирол
3. этанол
4. толуол
5. этандиол-1,2
Из предложенного перечня выберите все вещества, с которыми реагирует этилен.
1) HBr
2) NaOH
3) Br2
4) Cu(OH)2
5) H2O
Из предложенного перечня выберите два вещества, с которыми реагируют аминокислоты.
1. ароматические углеводороды
2. одноатомные спирты
3. простые эфиры
4. непредельные углеводороды
5. аминокислоты
Установите соответствие между углеводородом и продуктом, который преимущественно образуется при его взаимодействии с хлором в соотношении 1:1. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УГЛЕВОДОРОД
А) изобутан
Б) бутен-2
В) бутадиен-1,3
Г) бутан
ПРОДУКТ ХЛОРИРОВАНИЯ
1) 2,3-дихлорбутан
2) 1,4-дихлорбутан
3) 2-метил-2-хлорпропан
4) 1,2-дихлорбутан
5) 1,4-дихлорбутен-2
6) 2-хлорбутан
Установите соответствие между схемой реакции и веществом X, которое является одним из реагентов в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) X + СuО → формальдегид + Сu + Н2О
Б) X + КМnO4(Н+) → ацетон + К+ + Мn+2 + Н2O
В) X + H2SO4 (конц.) → диметиловый эфир + Н2O
Г) X + К → этилат калия + Н2
ВЕЩЕСТВО X
1) муравьиная кислота
2) уксусная кислота
3) метанол
4) этанол
5) пропанол-1
6) пропанол-2
Задана следующая схема превращений веществ:
ацетилен [math]\xrightarrow X[/math] этаналь [math]\xrightarrow Y[/math] этанол
Определите, какие из указанных веществ являются веществами X и Y.
1. Н2(кат.)
2. H2O2
3. Н2O (Hg2+)
4. КМnO4 (H+)
5. O2 (кат.)
Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие гидроксида цинка и соляной кислоты.
1. не окислительно-восстановительная
2. каталитическая
3. реакция обмена
4. обратимая
5. гетерогенная
Из предложенного перечня выберите все воздействия, которые увеличат скорость гидрирования пропена:
1. Повышение концентрации водорода
2. Понижение давления
3. Повышение температуры
4. Добавление пропана
5. Введение никеля
Установите соответствие между уравнением реакции и свойством элемента серы, которое она проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ
А) H2S + Mg = H2 + MgS
Б) H2 + S = H2S
В) S + Cl2 = SCl2
СВОЙСТВО СЕРЫ
1) является окислителем
2) является восстановителем
3) является и окислителем, и восстановителем
4) не проявляет окислительно-восстановительных свойств
Установите соответствие между названием металла и электролитическим способом его получения.
МЕТАЛЛ
А) калий
Б) медь
В) хром
Г) кальций
СПОСОБ ПОЛУЧЕНИЯ
1) электролиз водного раствора сульфата
2) электролиз расплавленного хлорида
3) электролиз расплавленного нитрата
4) электролиз водного раствора гидроксида

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке возрастания значения pH их водных растворов.
1) С17H35COONa
2) CsNO3
3) C6H5NH3Cl
4) HNO3
Установите соответствие между уравнением обратимой химической реакции и одновременным изменением внешних условий, приводящих к смещению химического равновесия в сторону продуктов реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ
А) H2(г) + F2(г) [math]\rightleftarrows[/math] 2HF(г) + Q
Б) H2(г) + I2(тв.) [math]\rightleftarrows[/math] 2HI(г) - Q
В) CO(г) + H2O(г) [math]\rightleftarrows[/math] CO2(г) + H2(г) + Q
Г) C4H10(г) [math]\rightleftarrows[/math] C4H6(г) + 2H2(г) - Q
ИЗМЕНЕНИЕ ВНЕШНИХ УСЛОВИЙ
1) увеличение температуры и концентрации водорода
2) уменьшение температуры и концентрации водорода
3) увеличение температуры и уменьшение концентрации водорода
4) уменьшение температуры и увеличение концентрации водорода
В реактор постоянного объёма поместили оксид азота(II) и кислород. В результате протекания обратимой реакции 2NO (г.) + O2 (г.) ⇋ 2NO2 (г.) в реакционной системе установилось химическое равновесие, при котором концентрации оксида азота(II), кислорода и оксида азота(IV) составили 0,2 моль/л, 0,4 моль/л и 0,8 моль/л соответственно. Определите исходные концентрации NO (X) и O2 (Y).
Выберите из списка номера правильных ответов.
1) 0,2 моль/л
2) 0,4 моль/л
3) 0,6 моль/л
4) 0,8 моль/л
5) 1,0 моль/л
6) 1,2 моль/л
Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить их водные этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛЫ ВЕЩЕСТВ
А) Al(NO3)3 и Ca(NO3)
Б) Na3PO4 и Na2SO4
В) КВr и НСl
Г) KI и NaNO3
РЕАКТИВ
1) AlCl3(p-p)
2) AgNO3
3) Fe
4) KOH(р-р)
5) ВаСl2(р-р)
Установите соответствие между веществом и промышленным способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
МЕТАЛЛ
А) алюминий
Б) железо
В) натрий
Г) литий
СПОСОБ ПОЛУЧЕНИЯ
1) восстановлением углем из оксида
2) электролизом расплава соли
3) вытеснением из расплава соли магнием
4) восстановлением хромом из оксида
5) электролизом расплава оксида в криолите
Из 150 г раствора с массовой долей бромида натрия 6% выпарили 10г воды и добавили 5 г той же соли. Чему равна массовая доля соли в полученном растворе? (Запишите число с точностью до десятых.)
Ответ: _____________ %
В результате реакции, термохимическое уравнение которой
СН4(г) + 2O2(г) = СO2(г) + 2Н2O(г) + 896 кДж
выделилось 1792 кДж теплоты. Определите массу сгоревшего метана. (Запишите число с точностью до целых.)
Ответ:___________________г
Определите массу оксида цинка (кг), который можно получить при обжиге 900 кг содержащего ZnS минерала сфалерита, если известно, что массовая доля примесей в сфалерите составляет 11%. (Запишите число с точностью до целых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Азотная кислота, оксид меди(I), сероводород, ацетат аммония, оксид железа(III), оксид хрома(VI). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется соль, выделяется бурый газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
Cu2O + 6HNO3 = 2Cu(NO3)2 + 2NO2 + 3H2O
2) Указан электронный баланс
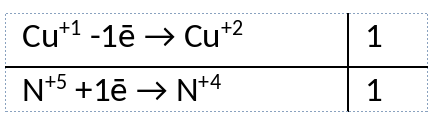
3) Указано, что азот в степени окисления +5 (азотная кислота) является окислителем, а медь в степени окисления +1 (оксид меди(I)) является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции не образуется осадок, не выделяется газ. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
CH3COONH4 + HNO3 = CH3COOH + NH4NO3
2) Написано полное ионное уравнение:
NH4++ CH3COO- + H+ + NO3- = CH3COOH + NH4+ + NO3-
3) Написано сокращённое ионное уравнение:
CH3COO- + H+ = CH3COOH
Железную окалину растворили в концентрированной азотной кислоте. К полученному раствору добавили раствор гидроксида натрия. Выделившийся осадок отделили и прокалили. Образовавшийся твёрдый остаток сплавили с железом. Напишите уравнения четырёх описанных реакций.
1) Fe3O4 + 10HNO3 = 3Fe(NO3)3 + NO2 + 5H2O
2) Fe(NO3)3 + 3NaOH = 3NaNO3 + Fe(OH)3↓
3) 2Fe(OH)3 = Fe2O3 + 3H2O (при нагревании)
4) Fe2O3 + Fe = 3FeO (при нагревании)
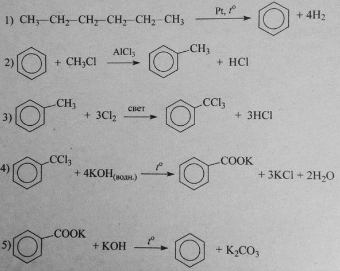
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
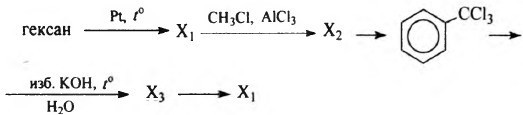
При написании уравнений реакций используйте структурные формулы органических веществ.
При сгорании 18,8 г органического вещества получили 26,88 л (н.у.) углекислого газа и 10,8 мл воды. Известно, что это вещество реагирует как с гидроксидом натрия, так и с бромной водой.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции данного вещества с бромной водой.
Общая формула вещества - CxHyOz
1) Найдены количество вещества углекислого газа и воды:
n(CO2) = 26,88 / 22,4 =1,2 моль
n(H2O) = 10,8 / 18 = 0,6 моль
2) Определена молекулярная формула вещества:
n(С) = n(СO2) = 1,2 моль
m(C) = 1,2 * 12 = 14,4 г
n(H) = 2n(H2O) = 1,2 моль
m(H) = 1,2 г
m(O) = 18,8 - 14,4 - 1,2 = 3,2 г
n(O) = 3,2 / 16 = 0,2 моль
x : y : z = 1,2 : 1,2 : 0,2 = 6 : 6 : 1
Молекулярная формула - C6H6O
3) Составлена структурная формула вещества:
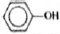
4) Составлено уравнение реакции данного вещества с бромной водой:
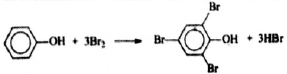
В две колбы налили по 350 г концентрированной азотной кислоты. Затем во вторую колбу добавили 250 г воды. В каждой колбе растворили по кусочку меди. При этом объём бурого газа, выделившегося в первой колбе, оказался равным объёму бесцветного газа, выделившегося во второй колбе. (Выход преимущественно образующегося газа считать равным 100%). Газ, выделившийся в первой колбе, поглотили раствором гидроксида калия. При этом все вещества прореагировали полностью и образовалось 375,6 г слабощелочного раствора с массовой долей атомов водорода 8,36%. Вычислите массовую долю соли в растворе, полученном после растворения меди во второй колбе.
Элементы ответа:
Записаны уравнения реакций:
[1] Cu + 4HNO3(конц.) ⟶ Cu(NO3)2 + 2NO2 + 2H2O
[2] 3Cu + 8HNO3(разб.) ⟶ 3Cu(NO3)2 + 2NO + 4H2O
[3] 2KOH + 2NO2 ⟶ KNO3 + KNO2 + H2O
2. Найдем число моль атомов водорода:
m H = mконечн. р-ра · ω H = 375,6 · 0,0836 = 31,4 г
n H = m H / M H = 31,4 / 1 = 31,4 моль
3. Найдем массу воды в конечном растворе:
n H2O = n H / 2 = 31,4 / 2 = 15,7 моль
m H2O = n H2O · M H2O = 15,7 · 18 = 282,6 г
4. Найдем число моль солей в конечном растворе:
m (KNO3 + KNO2) = mконечн. р-ра – m H2O = 375,6 – 282,6 = 93 г
Пусть n KNO3 = n KNO2 = x моль, тогда
m KNO3 = n KNO3 · M KNO3 = 101x г
m KNO2 = n KNO2 · M KNO2 = 85x г
m KNO3 + m KNO2 = 93
101x + 85x = 93
x = 0,5
n KNO3 = n KNO2 = 0,5 моль
5. Найдем массу оксида азота(II):
n NO2 = 2n KNO3 = 2 · 0,5 = 1 моль
По условию V NO2 = V NO, тогда n NO = n NO2 = 1 моль
m NO = n NO · M NO = 1 · 30 = 30 г
6. Найдем массу раствора во второй колбе после протекания реакции:
n Cu = 3n NO / 2 = 3 · 1 / 2 = 1,5 моль
m Cu = n Cu · M Cu = 1,5 · 64 = 96 г
mр-ра во 2 колбе = mр-ра HNO3 + m H2O + m Cu – m NO = 350 + 250 + 96 – 30 = 666 г
7. Найдем массовую долю нитрата меди(II) во второй колбе:
n Cu(NO3)2 = n Cu = 1,5 моль
m Cu(NO3)2 = n Cu(NO3)2 · M Cu(NO3)2 = 1,5 · 188 = 282 г
ω Cu(NO3)2 = m Cu(NO3)2 / mр-ра во 2 колбе = 282 / 666 = 0,4234 → 42,34%| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||