Вариант 10
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Хлорид-ион имеет такую же электронную конфигурацию, как и:
1. катион кальция
2. гидрид-анион
3. атом брома
4. атом натрия
5. сульфид-анион
Из указанных в ряду химических элементов выберите три элемента, водородные соединения которых являются кислотами. Расположите выбранные элементы в порядке увеличения кислотности их водородных соединений.
1) P
2) S
3) Ca
4) Cl
5) I
Из указанных в ряду элементов выберите два элемента, которые в соединениях проявляют валентность I.
1) V
2) Br
3) S
4) As
5) I
Из предложенного перечня выберите два свойства, которые характеризуют вещества с молекулярной кристаллической решёткой.
1) высокая электропроводность в кристаллическом состоянии
2) низкая температура плавления
3) высокая твёрдость
4) высокая электропроводность в расплаве
5) высокая летучесть
Среди предложенных названий и формул веществ, расположенных в пронумерованных ячейках, выберите названия или формулы: А) одноосновной кислоты, Б) амфотерного оксида, В) щёлочи.
В пробирку с раствором вещества Х пропускали углекислый газ, в результате чего наблюдали образование осадка. В другую пробирку с осадком вещества Y добавили воду и пропускали углекислый газ. В результате реакции наблюдали растворение осадка. Из предложенного перечня выберите вещества Х и Y, которые участвовали в описанных реакциях.
1) гидроксид алюминия
2) гидрокарбонат кальция
3) карбонат кальция
4) гидроксид стронция
5) гидросульфит калия
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) CaO
Б) Cl2
В) Al(OH)3
Г) HF
РЕАГЕНТЫ
1) KOH, FeCl2, P
2) SiO2, Zn, KOH
3) C, H2O, ZnO
4) Zn, HNO3, S
5) HCl, NaOH, K2O
Установите соответствие между исходными веществами и основным продуктом их взаимодействия.
ФОРМУЛЫ ВЕЩЕСТВ
А) Аl(ОН)3 + RbOH (водн. р-р)
Б) Аl(ОН)3 + Rb2O 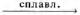
В) Аl(ОН)3 + CsOH 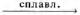
Г) Аl(ОН)3 + Cs2CO3 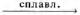
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) RbAlO2
2) Rb3[Al(OH)6]
3) CsAlO2
4) Cs3[Al(OH)6]
Задана следующая схема превращений веществ:
[math]Fe\xrightarrow XFeCl_3\xrightarrow YFe(OH)_3[/math]
Определите, какие из указанных веществ являются веществами X и Y.
1. НСl
2. Cu(OH)2
3. КНСО3(р-р)
4. Сl2
5. Аl(ОН)3
Установите соответствие между названием органического соединения и классом, к которому оно принадлежит.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) метанол
Б) стирол
В) глицерин
Г) дивинил
КЛАСС СОЕДИНЕНИЙ
1) простые эфиры
2) сложные эфиры
3) предельные спирты
4) углеводороды
5) предельные карбоновые кислоты
6) ненасыщенные карбоновые кислоты
Атомы углерода только в sр2-гибридном состоянии находятся в молекулах
1. бензола
2. ацетилена
3. пропена
4. толуола
5. этилена
Из предложенного перечня выберите все вещества, которые вступают в реакцию полимеризации.
1) этан
2) толуол
3) изопрен
4) стирол
5) дивинил
Из предложенного перечня выберите два вещества, с которыми реагируют и глицин, и этиламин.
1. гидроксид калия
2. оксид натрия
3. фосфорная кислота
4. фтороводород
5. оксид углерода(II)
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) хлорэтан и натрий
Б) хлорэтан и КОН(спирт.)
В) этен и вода
Г) бутен-2 и водород
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) этан
2) этен
3) этанол
4) бутен-1
5) этаналь
6) бутан
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) 2-хлорбутан и KOH(спиртов.)
Б) 1-хлорбутан и КОН(водн)
В) 1-хлорбутан и NH3
Г) С4Н10 и HONO2
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) бутен-1
2) бутанол-1
3) бутиламин
4) нитробутан
5) бутилнитрит
6) бутен-2
В заданной схеме превращений
[math]CH_3COOH\xrightarrow XCICH_2COOH\xrightarrow YNH_2CH_2COOH[/math]
веществами X и Y соответственно являются:
1. HCl
2. Cl2
3. AlCl3
4. NH3
5. NH4Cl
Из предложенного набора веществ выберите все вещества, термическое разложение которых относится к окислительно-восстановительным реакциям.
1. NH4NO2
2. Al(OH)3
3. CaCO3
4. HNO3
5. H2SiO3
Из предложенного перечня выберите все факторы, под воздействием которых увеличится скорость реакции хлорирования метана на свету:
1. Повышение температуры
2. Уменьшение объема реакционного сосуда
3. Повышение концентрации хлорметана
4. Повышение концентрации хлора
5. Понижение давления
Установите соответствие между уравнением реакции и свойством элемента серы, которое она проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ
А) SO2 + Mg(OH)2 = H2O + MgSO3
Б) Zn + S = ZnS
В) 2S + Cl2 =S2Cl2
СВОЙСТВО СЕРЫ
1) является окислителем
2) является восстановителем
3) является и окислителем, и восстановителем
4) не проявляет окислительно-восстановительных свойств
Установите соответствие между формулой соли и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества.
ФОРМУЛА СОЛИ
А) Na2HPO4
Б) ВаСl2
В) Al2(SO4)3
Г) Сu(СlO3)2
КАТОДНЫЙ ПРОДУКТ
1) натрий
2) барий
3) алюминий
4) медь
5) водород
6) кислород

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке убывания значения pH их водных растворов.
1) Cульфит калия
2) Нитрат магния
3) Сульфат калия
4) Гидроксид калия
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе:
УРАВНЕНИЕ РЕАКЦИИ
А) N2(г) + ЗН2(г) [math]\rightleftarrows[/math] 2NH3(г)
Б) 2Н2(г) + O2(г) [math]\rightleftarrows[/math] 2Н2O(г)
В) Н2(г) + Cl2(г) [math]\rightleftarrows[/math] 2НСl(г)
Г) SO2(г) + Сl2(г) [math]\rightleftarrows[/math] SO2Cl2(г)
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили оксид углерода(II) и водород. При этом исходная концентрация оксида углерода(II) составляла 0,5 моль/л. В результате протекания обратимой реакции CO (г.) + 3H2 (г.) ⇋ CH4 (г.) + H2O (г.) в реакционной системе установилось химическое равновесие, при котором концентрации водорода, метана и воды составили 0,1 моль/л, 0,2 моль/л и 0,2 моль/л соответственно. Определите равновесную концентрацию CO (X) и исходную концентрацию H2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,3 моль/л
3) 0,5 моль/л
4) 0,7 моль/л
5) 0,9 моль/л
6) 1,1 моль/л
Установите соответствие между веществами и реагентом, с помощью которого их можно отличить друг от друга.
ВЕЩЕСТВА
А) ацетилен и этилен
Б) этилен и этан
В) этандиол-1,2 и этанол
Г) фенол и этанол
РЕАГЕНТ
1) Br2(aq)
2) [Ag(NH3)2]OH
3) Аl(ОН)3
4) H2SO4 (р-р)
5) Cu(OH)2
В качестве удобрений используют нитраты
1) аммония
2) алюминия
3) железа(II)
4) железа(III)
5) калия
Сколько граммов едкого натра следует растворить в 300 г 5%-ного раствора для получения 10%-ного раствора NaOH? (Запишите число с точностью до десятых.)
Ответ: ____________________г.
Какой объём газа (н.у.) не вступит в реакцию, если сжигать 40 л угарного газа в 40 л кислорода? (Запишите число с точностью до целых.)
Ответ: ___________________л.
При обработке загрязнённого образца сульфида алюминия кислотой выделилось 6720 мл (н.у.) сероводорода и осталось 5 г нерастворившегося осадка. Вычислите массовую долю (%) примесей в указанном образце сульфида алюминия. (Запишите число с точностью до целых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Сульфид железа(II), гидроксид калия, перманганат калия, серная кислота, нитрит калия, гидрокарбонат бария. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется бесцветный раствор, не образуется осадок и не выделяется газ. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
2KMnO4 + 5KNO2 + 3H2SO4 = 2MnSO4 + 3H2O + 5KNO3 + K2SO4
2) Указан электронный баланс
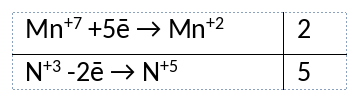
3) Указано, что марганец в степени окисления +7 (перманганат калия) является окислителем, а азот в степени окисления +3 (нитрит калия) является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции выделяется газ и не образуется осадок. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
FeS + H2SO4 = FeSO4 + H2S
2) Написано полное ионное уравнение:
FeS + 2H+ + SO42- = Fe2+ + SO42- + H2S
3) Написано сокращённое ионное уравнение:
FeS + 2H+ = Fe2+ + H2S
Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем его полное растворение с образованием тёмно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди.
Запишите уравнения описанных реакций.
1) 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
2) Cu(NO3)2 + 2NH3 H2O = Cu(OH)2 ↓ + 2NH4NO3
3) Cu(OH)2 + 4NH3 H2O = [Cu(NH3)4](OH)2 + 4H2O
4) [Cu(NH3)4](OH)2 + 3H2SO4 = CuSO4 + 2(NH4)2SO4 + 2H2O
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
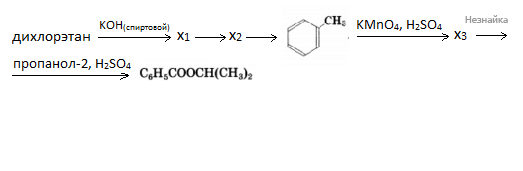
При написании уравнений реакций используйте структурные формулы органических соединений.
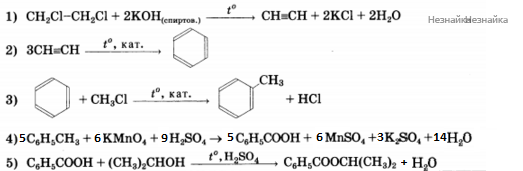
При сгорании 4,6 г органического вещества образуется 8,8 г углекислого газа и 5,4 г воды. Указанное вещество жидкое при н.у., реагирует с металлическим натрием и масляной кислотой. На основании этих данных:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) приведите уравнение реакции его взаимодействия с масляной кислотой.
2) молекулярная формула C2H6O
3) структурная формула CH3—CH2—OH
4) уравнение реакции C3H7COOH + C2H5OH → C3H7COOC2H5 + H2O
Смесь аммиака и углекислого газа объёмом 11,2 л (н.у.) полностью поглотили водой, объём которой 100 мл, при этом образовалась средняя соль. К полученному раствору добавили раствор хлорида железа(II). При этом образовалось 214 г раствора с массовой долей единственного растворённого вещества 10%. Вычислите массовую долю хлорида железа(II) в добавленном растворе. Процессами гидролиза пренебречь.
Элементы ответа:
1. Записаны уравнения реакций:
[1] 2NH3 + CO2 + H2O ⟶ (NH4)2CO3
[2] FeCl2 + (NH4)2CO3 ⟶ FeCO3 + 2NH4Cl
[3] FeCl2 + 2NH3 + 2H2O ⟶ Fe(OH)2 + 2NH4Cl
2. По условию исходные вещества полностью вступили в реакции 2 и 3, так как после в растворе осталось
единственное вещество – NH4Cl. Найдем общее число моль хлорида аммония:
m NH4Cl = mр-ра NH4Cl · ω NH4Cl = 214 · 0,1 = 21,4 г
n NH4Cl = m NH4Cl / M NH4Cl = 21,4 / 53,5 = 0,4 моль
3. Найдем число моль смеси газов:
nсмеси = Vсмеси / Vm = 11,2 / 22,4 = 0,5 моль
4. Найдем число моль хлорида аммония, образовавшегося во второй и в третьей реакциях:
Пусть n2 NH4Cl = x моль, тогда n (NH4)2CO3 = n CO2 = 0,5x моль;
Пусть n3 NH4Cl = y моль, тогда n3 NH3 = y моль
n2 NH4Cl + n3 NH4Cl = n NH4Cl
x + y = 0,4
n1 NH3 = 2n (NH4)2CO3 = x моль
n1 NH3 + n3 NH3 + n CO2 = nсмеси
x + y + 0,5x = 0,5
x + y = 0,4
x + y + 0,5x = 0,5
x = 0,2; n2 NH4Cl = 0,2 моль;
y = 0,2; n3 NH4Cl = 0,2 моль
5. Найдем массу карбоната железа(II) и гидроксида железа(II), выпавших в осадок:
n FeCO3 = n2 NH4Cl / 2 = 0,2 / 2 = 0,1 моль
m FeCO3 = n FeCO3 · M FeCO3 = 0,1 · 116 = 11,6 г
n Fe(OH)2 = n3 NH4Cl / 2 = 0,2 / 2 = 0,1 моль
m Fe(OH)2 = n Fe(OH)2 · M Fe(OH)2 = 0,1 · 90 = 9 г
6. Выразим массу итогового раствора и найдем массу раствора хлорида железа(II):
mконечн. р-ра = m NH3 + m CO2 + m H2O + mр-ра FeCl2 – m FeCO3 – m Fe(OH)2 = 214
n1 NH3 = 2n (NH4)2CO3 = 0,2 моль
n3 NH3 = n3 NH4Cl = 0,2 моль
m NH3 = (n1 NH3 + n3 NH3) · M NH3 = 0,4 · 17 = 6,8 г
n CO2 = n (NH4)2CO3 = 0,1 моль
m CO2 = n CO2 · M CO2 = 0,1 · 44 = 4,4 г
m H2O = V H2O · p H2O = 100 · 1 = 100 г
mр-ра FeCl2 = mконечн. р-ра – m NH3 – m CO2 – m H2O + m FeCO3 + m Fe(OH)2 = 214 – 6,8 – 4,4 – 100 + 11,6 + 9 = 123,4 г
7. Найдем массу хлорида железа(II):
n2 FeCl2 = n (NH4)2CO3 = 0,1 моль
n3 FeCl2 = n Fe(OH)2 = 0,1 моль
n FeCl2 = n2 FeCl2 + n3 FeCl2 = 0,1 + 0,1 = 0,2 моль
m FeCl2 = n FeCl2 · M FeCl2 = 0,2 · 127 = 25,4 г
8. Найдем массовую долю хлорида железа(II) в добавленном растворе:
ω FeCl2 = m FeCl2 / mконечн. р-ра = 25,4 / 123,4 = 0,2058 → 20,58%
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||