Вариант 8
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Электронную конфигурацию 1s22s22p6 имеют частицы:
1. Na
2. O
3. F-
4. Na+
5. S2-
Из указанных в ряду химических элементов выберите три p-элемента. Расположите выбранные элементы в порядке уменьшения кислотных свойств их высших оксидов.
1) Zn
2) C
3) Al
4) Cl
5) Ti
Из указанных в ряду элементов выберите два элемента, которые не проявляют валентности, равной номеру группы.
1) Mg
2) P
3) N
4) O
5) Ti
Из предложенного перечня выберите два вещества с молекулярной кристаллической решеткой, в которых содержатся только ковалентные полярные связи.
1) SiO2
2) HOCH2CH2OH
3) NH4Cl
4) CO2
5) CH3OCH3
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) кислой соли, Б) амфотерного оксида, В) сильной бескислородной кислоты.
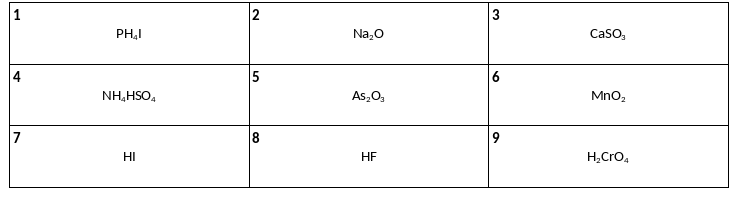
Даны две пробирки с раствором сульфата алюминия. В первую пробирку добавили раствор вещества Х, и в результате реакции наблюдали только образование осадка. Во вторую пробирку добавили раствор вещества Y, при этом наблюдали сначала образование осадка, а затем его растворение. Из предложенного перечня выберите вещества Х и Y, которые участвовали в описанных реакциях.
1) хлорид железа(ІІI)
2) гидроксид меди(ll)
3) пероксид водорода
4) гидроксид лития
5) бромид бария
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Cu(NO3)2
Б) CaO
В) SiO2
Г) AlCl3
РЕАГЕНТЫ
1) H3PO4, H2, NaBr
2) H2O, C, HCl
3) H2S, KOH, NaI
4) NaF, AgNO3, KOH
5) MgO, HF, BaCO3
Установите соответствие между простыми веществами и формулами реагентов, с которыми они могут взаимодействовать.
ПРОСТОЕ ВЕЩЕСТВО
А) Вr2
Б) H2
В) S
Г) Na
ФОРМУЛЫ РЕАГЕНТОВ
1) H2SO4(paзб.), Al
2) КОН, KI
3) С2Н4, O2
4) Сu, N2
5) O2, Аl
6) H2SO4(paзб.), S
В заданной схеме превращений
[math]Al\xrightarrow XAl(OH)_3\xrightarrow YAl(NO_3)_3[/math]
веществами X и Y соответственно являются:
1. NaOH
2. H2O
3. KОН
4. KNO3
5. HNO3
Установите соответствие между тривиальным и систематическим названиями соединений.
ТРИВИАЛЬНОЕ НАЗВАНИЕ
А) глицерин
Б) о-ксилол
В) дивинил
Г) изобутан
СИСТЕМАТИЧЕСКОЕ НАЗВАНИЕ
1) метилпропан
2) этандиол
3) пропантриол
4) 1,2-диметилбензол
5) 1,3-диметилбензол
6) бутадиен-1,3
Одинаковые функциональные группы содержат:
1. метанол и стирол
2. нитробензол и нитроглицерин
3. анилин и этиламин
4. глицерин и этин
5. пропанол-2 и фенол
Из предложенного перечня выберите все вещества, при гидратации каждого из которых образуется кетон.
1) этилен
2) ацетилен
3) пропин
4) 2-метилбутадиен-1,3
5) 3-метилбутин-1
Из предложенного перечня выберите два вещества, с которыми реагирует глюкоза.
1. Zn(OH)2
2. Ag2O (аммиачный раствор)
3. Сu(ОН)2
4. Н2O
5. СН2=СН2
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) циклопропан и бром
Б) циклогексан и бром
В) изобутан и бром
Г) бензоат натрия и NaOH
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) бромциклопропан
2) дибромпропан
3) бромциклогексан
4) дибромгексан
5) бензол
6) 2-бром-2-метилпропан
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) пропанол-1 и СuО
Б) пропанол-2 и СuО
В) пропанол-1 и Na
Г) пропанол-1 и Н2SO4(конц.)
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) пропилнатрий
2) пропен
3) пропаналь
4) пропанон
5) пропилат натрия
6) пропановая кислота
В заданной схеме превращений
этан [math]\xrightarrow X\dots\xrightarrow Y[/math] этанол
веществами X и Y соответственно являются:
1. НСl
2. Вr2
3. КОН(спиртов.)
4. КОН(водн.)
5. H2SO4(конц.)
Из предложенного перечня схем реакций выберите все схемы, соответствующие экзотермическим реакциям.
1. 2Na + 2H2O = 2NaOH + H2
2. 2SO3 = 2SO2 + O2
3. C3H8 + 5O2 = 3CO2 + 4H2O
4. CH4 + Cl2 = CH3Cl + HCl
5. Cu(OH)2 = CuO + H2O
Из предложенного перечня выберите все верные утверждения о скорости химической реакции.
1. Катализатор повышает скорость реакции и расходуется в ходе нее
2. Реакции ионного обмена между растворами веществ, как правило, протекают быстрее, чем реакции ионного обмена с участием твердого реагента и раствора вещества
3. Скорость растворения металлов в серной кислоте зависит от природы металла
4. Изменение давления влияет на скорость всех реакций, в которых образуются газы
5. На скорость экзотермических реакций не влияет температура
Установите соответствие между формулой иона и окислительно-восстановительными свойствами, которые он может проявлять: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ИОНА
А) Cu+
Б) Fe2+
В) Br-
СВОЙСТВО
1) только окислитель
2) только восстановитель
3) и окислитель, и восстановитель
4) не проявляет окислительно-восстановительных свойств
Установите соответствие между названием металла и промышленным электролитическим способом его получения.
МЕТАЛЛ
А) кальций
Б) серебро
В) натрий
Г) свинец
СПОСОБ ПОЛУЧЕНИЯ
1) электролиз водного раствора хлорида
2) электролиз водного раствора нитрата
3) электролиз расплавленного нитрата
4) электролиз расплавленного хлорида

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке возрастания значения pH их водных растворов.
1) CrCl3
2) SrBr2
3) KOH
4) NH3
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении температуры в системе.
УРАВНЕНИЕ РЕАКЦИИ
А) C6H12(г) [math]\rightleftarrows[/math] C6H6(г) + 3H2(г)
Б) 2SO3(г) [math]\rightleftarrows[/math] 2SO2(г) + O2(г)
В) N2(г) + 3H2(г) [math]\rightleftarrows[/math] 2NH3(г)
Г) N2(г) + O2(г) [math]\rightleftarrows[/math] 2NO(г)
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили метан и углекислый газ. При этом исходные концентрации метана и углекислого газа составляли 0,7 моль/л и 0,5 моль/л соответственно. В результате протекания обратимой реакции ½CH4 (г.) + ½CO2 (г.) ⇋ CO (г.) + H2 (г.) в реакционной системе установилось химическое равновесие, при котором концентрация углекислого газа составила 0,2 моль/л. Определите равновесные концентрации СН4 (X) и СО (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить их водные растворы: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛЫ ВЕЩЕСТВ
А) KCI и K2SO4
Б) ZnCl2 и MgCl2
В) HCI и NaCI
Г) NaOH и HNO3
РЕАКТИВ
1) NaNO3(p-p)
2) Ва(ОН)2 (р-р)
3) LiCl (р-р)
4) НВr
5) NaНСО3
Катализатор никель используется в технологических процессах:
1. окисление спиртов
2. восстановление альдегидов
3. дегидратация первичных спиртов
4. гидрирование алкенов
5. образование сложных эфиров
К 250 г 20%-ной серной кислоты добавили 50 мл 60%-ной кислоты (плотностью 1,6 г/мл). Какова массовая доля кислоты в полученном растворе? (Запишите число с точностью до целых.)
Ответ: ____________________%.
В результате реакции, термохимическое уравнение которой
H+(р-p) + ОН (р-р) = Н2O(ж) + 57 кДж,
выделилось 28,5 кДж теплоты. Какая масса азотной кислоты была нейтрализована гидроксидом калия? (Запишите число с точностью до десятых.)
Ответ: ____________________г.
На растворение природного известняка был затрачен раствор, содержащий 289,8 г азотной кислоты. При этом осталось 34 г не растворившегося в кислоте осадка. Вычислите массовую долю (%) примесей в указанном известняке. (Запишите число с точностью до десятых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Иодид калия, ацетат натрия, серная кислота, хлорид стронция, хлорид меди(II), карбонат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. Реакция протекает с изменением цвета раствора, выпадает белый осадок. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
1) Написано уравнение реакции
2CuCl2 + 4KI = 2CuI + I2 + 4KCl
2) Указан электронный баланс
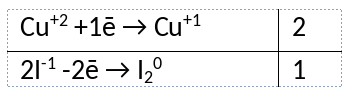
3) Указано, что медь в степени окисления +2 (хлорид меди(II)) является окислителем, а иод в степени окисления -1 (иодид калия) является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции не выделяется газ, не выпадает осадок. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
2CH3COONa + H2SO4 = 2CH3COOH + Na2SO4
2) Написано полное ионное уравнение:
2CH3COO- + 2Na+ + 2H+ + SO42- = 2CH3COOH + 2Na+ + SO42-
3) Написано сокращённое ионное уравнение:
CH3COO- + H+ = CH3COOH
Магний растворили в разбавленной азотной кислоте, причём выделение газа не наблюдалось. Получившийся раствор обработали избытком раствора гидроксида калия при нагревании. Выделившийся при этом газ сожгли в кислороде.
Запишите уравнения описанных реакций.
1) 4Mg + 10HNO3 = 4Mg(NO3)2 + NH3NO3 + 3H2O
2) Mg(NO3)2 + 2KOH = Mg(OH)2 ↓ + 2KNO3
3) NH4NO3 + KOH  KNO3 + NH3 ↑ + H2O
KNO3 + NH3 ↑ + H2O
4) 4NH3 + 3O2 = 2N2 + 6H2O
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
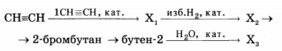
При написании уравнений реакций используйте структурные формулы органических соединений.
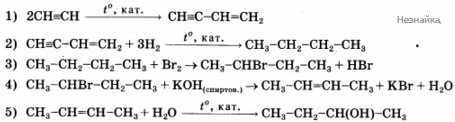
При сгорании 2,9 г органического вещества образуется 3,36 л углекислого газа и 2,7 г воды. Плотность паров этого вещества по водороду 29. Установлено, что это вещество взаимодействует с аммиачным раствором оксида серебра, каталитически восстанавливается водородом с образованием первичного спирта и способно окисляться подкисленным раствором дихромата калия до карбоновой кислоты. На основании этих данных:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) приведите уравнение реакции его взаимодействия с аммиачным раствором оксида серебра.
2) молекулярная формула C3H6O
3) структурная формула 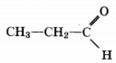
4) уравнение реакции CH3CH2C(O)H + 2[Ag(NH3)2]OH → CH3CH2COO NH4+ + 2Ag + 3NH3 + H2O
Растворимость оксида серы (IV) составляет 40 л (н.у.) на 1 л воды, а растворимость хлора − 2,24 л (н.у.) на 1 л воды. Смешали их насыщенные растворы, при этом вещества прореагировали полностью. К полученному раствору добавили раствор гидроксида бария. Масса конечного раствора, имеющего нейтральную среду, составила 2080 г, а массовая доля единственного растворенного вещества составила 1%. Вычислите массовую долю гидроксида бария в добавленном растворе.
Элементы ответа:
Записаны уравнения реакций:
(1) SO2 + Cl2 + 2H2O = H2SO4 + 2HCl
(2) 2HCl + Ba(OH)2 = BaCl2 + 2H2O
(2) H2SO4 + Ba(OH)2 = BaSO4 ↓ + 2H2O
Вычислено количество исходных веществ
m(BaCl2) = m(p-pa) • ω = 2080 • 0,01 = 20,8 г
n(BaCl2) = m : M = 20,8 : 208 = 0,1 моль
n(Cl2) = n(BaCl2) = 0,1 моль
n(SO2) = n(Cl2) = 0,1 моль
V(Cl2) = V(SO2) = VM • n = 22,4 • 0,1 = 2,24 л
m(H2O) = 1000 • 1 = 1000 г
2,24 : 1000 = 2,24 : х
х = 1000 г
mp-pa(Cl2) = 1000 + 71 • 0,1 = 1007,1 г
40 : 1000 = 2,24 : y
y = 56 г
mp-pa(SO2) = 56 + 64 • 0,1 = 62,4 г
Вычислена масса раствора гидроксида бария
m(конеч. р-ра) = mp-pa(Cl2) + mp-pa(SO2) + mp-pa(Ba(OH)2) − m(BaSO4) = 2080 г
m(конеч. р-ра) = 1007,1 + 62,4 + mp-pa(Ba(OH)2) − 233 • 0,1 = 2080 г
mp-pa(Ba(OH)2) = 2080 + 23,3 − 62,4 − 1007,1 = 1033,8 г
Вычислена массовая доля гидроксида бария в добавленном растворе
m(Ba(OH)2) = n • M = (0,1 + 0,1) • 171 = 34,2 г
ω(Ba(OH)2) = 34,2 : 1033,8 • 100% = 3,308%
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||