Вариант 7
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Электронную конфигурацию, аналогичную конфигурации оксид-иона, имеют частицы:
1. Fe2+
2. Br7+
3. S2-
4. Na+
5. F-
Из указанных в ряду химических элементов выберите три элемента, которые образуют оксиды. Расположите выбранные элементы в порядке уменьшения кислотных свойств их высших оксидов.
1) Si
2) S
3) F
4) Zn
5) Ar
Из числа указанных в ряду элементов выберите два элемента, которые не проявляют степени окисления, равной номеру группы.
1) F
2) O
3) N
4) S
5) Cl
Из предложенного перечня выберите два вещества с ионной кристаллической решеткой, которые содержат ковалентные связи.
1) H2SO4
2) BaCl2
3) Na2O2
4) SiO2
5) KOH
Среди предложенных названий веществ, расположенных в пронумерованных ячейках, выберите названия: А) соли, Б) смешанного оксида, В) основания.
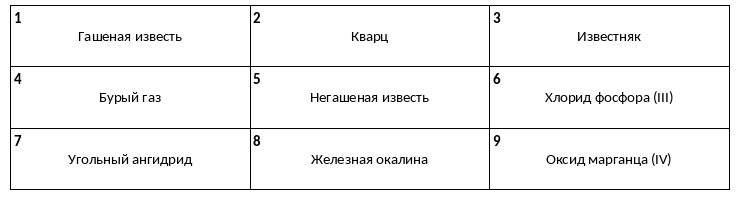
В пробирку с раствором вещества Х пропускали аммиак, в результате чего наблюдали выпадение осадка. В другую пробирку с раствором сильного электролита Y также пропускали аммиак, в результате чего происходила реакция, которая не сопровождалась какими-либо видимыми признаками. Из предложенного перечня выберите вещества Х и Y, которые участвовали в описанных реакциях.
1) гидроксид магния
2) фтороводородная кислота
3) сульфат лития
4) бромоводород
5) хлорид алюминия
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Si
Б) LiOH
В) SO2
Г) Fe
РЕАГЕНТЫ
1) NaF, ZnO, Cl2
2) MgO, Fe2(SO4)3, O2
3) Cl2, KOH, Ca
4) H2SO4, P, Na2O
5) HNO3, O2, Pb(NO3)2
Установите соответствие между простыми веществами и формулами реагентов, с которыми они могут взаимодействовать.
ПРОСТОЕ ВЕЩЕСТВО
А) Na
Б) I2
В) N2
Г) H2
ФОРМУЛЫ РЕАГЕНТОВ
1) КОН, Сl2
2) Н2O, НСl
3) H2SO4, Аl
4) С2Н4, O2
5) Сu, N2
6) O2, Аl
В заданной схеме превращений
[math]Fe\xrightarrow XFe_3O_4\xrightarrow YFeO[/math]
веществами X и Y соответственно являются:
1. O2
2. CO2
3. C
4. HCl
5. H2SO4
Установите соответствие между общей формулой гомологического ряда и представителем этого ряда.
ФОРМУЛА РЯДА
А) СnН2n + 2
Б) СnН2n
В) СnН2n - 2
Г) СnН2n - 6
ПРЕДСТАВИТЕЛЬ РЯДА
1) бензол
2) циклогексин
3) изобутан
4) Пропин
5) циклобутан
6) стирол
Из предложенного перечня выберите два вещества, молекулы которых содержат гидроксильную группу.
1. бензол
2. стирол
3. этанол
4. толуол
5. фенол
Из предложенного перечня выберите все реакции, в результате которых образуется алкан.
1) электролиз раствора ацетата натрия
2) гидролиз карбида алюминия
3) гидратация ацетилена
4) нагревание ацетата калия со щелочью
5) деполимеризация полистирола
Из предложенного перечня выберите два вещества, относящихся к полисахаридам.
1. рибоза
2. крахмал
3. сахароза
4. целлюлоза
5. фруктоза
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) пропен и хлороводород
Б) ацетилен и водород
В) ацетилен и вода
Г) циклопропан и хлороводород
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) этен
2) этаналь
3) 1-хлорпропан
4) 2-хлорпропан
5) 1,2-дихлорпропан
6) хлорциклопропан
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) HO-CH2-CH2-OH и Cu(OH)2
Б) НСООН и СuО
В) НСНО и O2
Г) НСНО и С6Н5ОН
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) ацетат меди
2) гликолят меди
3) формиат меди
4) фенолформальдегидная смола
5) муравьиная кислота
6) фенол
В заданной схеме превращений
[math]CH_3OH\xrightarrow XC_6H_5COOСH_3\xrightarrow YCH_3OH[/math]
веществами X и Y соответственно являются:
1. С6Н5ОН
2. С6Н5СООН
3. КОН
4. CO2
5. AlCl3
Из предложенного перечня схем реакций выберите все гетерогенные реакции.
1. Fe2O3 + C →
2. CaO + HCl (р-р) →
3. HCOOH + CH3OH →
4. AgNO3 (р-р) + HCl (р-р) →
5. C2H6 + Cl2 →
Из предложенного перечня выберите все факторы, от которых скорость химической реакции между магнием и раствором сульфата меди (II) не зависит.
1. Концентрации сульфата магния
2. Температура
3. Объём реакционного сосуда
4. Площадь поверхности соприкосновения реагентов
5. Концентрация сульфата меди (II)
Установите соответствие между схемой реакции и свойством, которое проявляет атом азота в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) Na + NH3 → NaNH2 + H2
Б) CH3NH2 + HNO2 → CH3OH + N2 + H2O
В) (NH4)2Cr2O7 → N2 + Cr2O3 + H2O
СВОЙСТВО АЗОТА
1) является окислителем
2) является восстановителем
3) является и окислителем, и восстановителем
4) не проявляет окислительно-восстановительных свойств
Установите соответствие между формулой соли и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества.
ФОРМУЛА СОЛИ
А) KF
Б) К2СO3
В) СuСl2
Г) KHSO4
АНОДНЫЙ ПРОДУКТ
1) кислород
2) галоген
3) водород
4) сера

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке возрастания значения pH их водных растворов.
1) C15H31COOK
2) [C2H5NH3]Br
3) HClO4
4) NaClO3
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении температуры в системе.
УРАВНЕНИЕ РЕАКЦИИ
А) СаСО3(тв.) [math]\rightleftarrows[/math] СаО(тв) + СO2(г)
Б) 2SO2(г) + O2(г) [math]\rightleftarrows[/math] 2SO3(г)
В) N2(г) + 3H2(г) [math]\rightleftarrows[/math] 2NH3(г)
Г) C(тв.) + CO2(г) [math]\rightleftarrows[/math] 2CO(г)
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили метан и кислород. При этом исходная концентрация метана составляла 0,8 моль/л. В результате протекания обратимой реакции CH4 (г.) + ½O2 (г.) ⇋ CO (г.) + 2H2 (г.) в реакционной системе установилось химическое равновесие, при котором концентрации кислорода, монооксида углерода и водорода составили 0,2 моль/л, 0,6 моль/л и 1,2 моль/л соответственно. Определите равновесную концентрацию СН4 (X) и исходную концентрацию О2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции.
ВЕЩЕСТВА
А) К3[Сr(ОН)6] + Н2O2
Б) Fe(OH)2 + Н2O2
В) Fe(OH)2 + H2SO4(paзб.)
Г) Fe(OH)3 + HNO3(конц.)
ПРИЗНАКИ РЕАКЦИИ
1) изменение окраски осадка
2) растворение осадка
3) выделение бурого газа
4) изменение окраски раствора
5) видимых признаков реакции нет
Ионы серебра Ag+ в растворе могут быть обнаружены с помощью ионов:
1. F-
2. Cl-
3. NO3
4. CrO42-
5. SO42-
К 200 г 5%-ного раствора хлорида аммония добавили 15 г этой же соли и столько же граммов воды. Чему равна массовая доля хлорида аммония в получившемся растворе? (Запишите число с точностью до целых.)
Ответ: ___________%.
В результате реакции, термохимическое уравнение которой
Н+(р-р) + ОН-(р-р) = Н2O(ж) + 57 кДж,
выделилось 171 кДж теплоты. Какая масса гидроксида натрия была нейтрализована соляной кислотой? (Запишите число с точностью до целых.)
Ответ: ___________________г.
Технический фосфат кальция массой 775 г, в котором массовая доля нефосфатных примесей составляет 20%, нагрели с кремнезёмом и углём. Реакция протекает в соответствии с уравнением
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
Вычислите массу (г) полученного фосфора. (запишите число с точностью до целых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Сульфид серебра(I), азотная кислота, перманганат калия, сульфат аммония, ацетат стронция, нитрат железа(III). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции выделяется бурый газ, не образуется простое вещество. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
1) Написано уравнение реакции
Ag2S + 8HNO3 = Ag2SO4 + 8NO2 + 4H2O
2) Указан электронный баланс
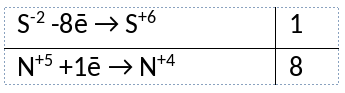
3) Указано, что азот в степени окисления +5 (азотная кислота) является окислителем, а сера в степени окисления -2 (сульфид серебра(I)) является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции образуется осадок. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
(NH4)2SO4 + (CH3COO)2Sr = SrSO4 + 2CH3COONH4
2) Написано полное ионное уравнение:
2NH4+ + SO42- + 2CH3COO- + Sr2+ = SrSO4 + 2CH3COO- + 2NH4+
3) Написано сокращённое ионное уравнение:
SO42- + Sr2+ = SrSO4
Раствор иодида калия обработали избытком хлорной воды, при этом наблюдали сначала образование осадка, а затем его полное растворение. Образовавшуюся при этом иодсодержащую кислоту выделили из раствора, высушили и осторожно нагрели. Полученный оксид прореагировал с угарным газом.
Запишите уравнения описанных реакций.
1) 2KI + Cl2 = 2KCl + I2
2) I2 + 5Cl2 + 6H2O = 10HCl + 2HIO3
3) 2HIO3 [math]\xrightarrow{t^\circ}[/math] I2O5 + H2O
4) I2O5 + 5CO = I2 + 5CO2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
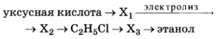
При написании уравнений реакций используйте структурные формулы органических соединений.
1) CH3COOH + NaOH → CH3COONa + H2O
2) 2CH3COONa + 2H2O  C2H6 ↑ + 2CO2 ↑ + H2 ↑ + 2NaOH
C2H6 ↑ + 2CO2 ↑ + H2 ↑ + 2NaOH
3) C2H5 + Cl2 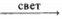 CH3—CH2—Cl + HCl
CH3—CH2—Cl + HCl
4) CH3—CH2—Cl + KOH (спиртов.) 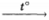 H2C = CH2 ↑ KCl + H2O
H2C = CH2 ↑ KCl + H2O
5) H2C = CH2 + H2O 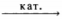 CH3—CH2—OH
CH3—CH2—OH
Некоторое органическое вещество, взаимодействуя с гидроксидом натрия, образует продукт, содержащий 33,82% металла. Известно, что это вещество может реагировать с этанолом и оксидом магния, а также окрашивает метилоранж в розовый цвет. На основании этих данных:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) приведите уравнение реакции его взаимодействия с оксидом магния.
2) молекулярная формула CH2O2
3) структурная формула 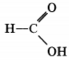
4) уравнение реакции 2HCOOH + MgO → (HCOO)2Mg + H2O
Газовую смесь, состоящую из водорода и угарного газа, взятых в массовом соотношении 8 : 7 сожгли в избытке кислорода. Продукты горения полностью поглотили раствором гидроксида натрия. При этом образовалось 265 г раствора, в котором массовая доля единственного растворенного вещества составляет 10%. Известно, что данный продукт реакции не реагирует со щелочью. Вычислите массовую долю исходного раствора гидроксида натрия.
Элементы ответа:
Записаны уравнения реакций:
(1) 2CO + O2 = 2CO2
(2) 2H2 + O2 = 2H2O
(3) 2NaOH + CO2 = Na2CO3 + H2O
Вычислено количество исходных веществ
m(Na2CO3) = m(p-pa) • ω = 265 • 0,1 = 26,5 г
n(Na2CO3) = m : M = 26,5 : 106 = 0,25 моль
n(CO2) = n(CO) = n(Na2CO3) = 0,25 моль
m(CO2) = M • n = 44 • 0,25 = 11 г
m(CO) = M • n = 28 • 0,25 = 7 г
m(CО) : m(Н2) = 7 : 8, отсюда 7 : x = 7 : 8
x = 8 г
n(Н2) = m : M = 8 : 2 = 4 моль
m(H2O) = M • n = 18 • 4 = 72 г
Вычислена масса раствора гидроксида натрия
m(конеч. р-ра) = m(CO2) + m(H2O) + mp-pa(NaOH) = 265 г
m p-pa(NaOH) = m(конеч. р-ра) – m(CO2) – m(H2O)
m p-pa(NaOH) = 265 − 11 − 72 = 182 г
Вычислена массовая доля гидроксида натрия в исходном растворе
n(NaOH) = n(CO2) • 2 = 0,25 • 2 = 0,5 моль
m(NaOH) = M • n = 40 • 0,5 = 20 г
ω(NaOH) = 20 : 182 • 100% = 11%
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||