Вариант 6
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Электронную конфигурацию, аналогичную конфигурации хлорид-иона, имеют частицы:
1. Fe3+
2. Br
3. S2-
4. H-
5. K+
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке ослабления основных свойств образуемых ими высших оксидов.
1) H
2) S
3) Si
4) Mg
5) Mn
Из числа указанных в ряду элементов выберите два элемента, которые имеют одинаковую разность между значениями их высшей и низшей степени окисления.
1) Cs
2) C
3) O
4) Cr
5) N
Из предложенного перечня выберите два вещества немолекулярного строения, в которых присутствует одинаковый тип химической связи.
1) Белый фосфор
2) Кремнезем
3) Пероксид водорода
4) Графит
5) Кремний
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) щелочи, Б) кислоты, В) амфотерного гидроксида.
Даны две пробирки с раствором гидроксида натрия. Первую пробирку добавили раствор вещества Х и немного нагрели. В результате в этой пробирке выделился газ с резким запахом. Во вторую пробирку добавили раствор вещества Y, при этом произошла реакция, которую описывает сокращённое ионное уравнение
HSO3– + OH– = SO32– + H2O
Из предложенного перечня выберите вещества Х и Y, которые участвовали в описанных реакциях.
1) гидросульфат аммония
2) серная кислота
3) сульфит кальция
4) нитрат меди(II)
5) гидросульфит калия
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Ca
Б) Cr2O3
В) Zn(OH)2
Г) NH4Cl
РЕАГЕНТЫ
1) KOH, H2O, K2SO4
2) N2, H2O, O2
3) NaOH, KOH, HBr
4) K2SiO3, Cu, AgBr
5) AgNO3, KOH, Ca(OH)2
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Н2O
Б) O2
В) Si
Г) CaSO4
РЕАГЕНТЫ
1) Р2O5, Na, Al2S3
2) H2S, FeO, NH3
3) Cl2, KOH, Ca
4) CO2, HF, CH4
5) H2S, NaOH, BaCl2
В заданной схеме превращений
[math]Fe\xrightarrow XFe_3O_4\xrightarrow YFeO[/math]
веществами X и Y соответственно являются:
1. HNO3
2. O2
3. H2
4. CO2
5. H2SO4
Установите соответствие между формулой соединения и классом, к которому это соединение принадлежит.
ФОРМУЛА СОЕДИНЕНИЯ
А) С3Н6O2
Б) CH5N
В) С3Н8O
Г) С2Н4O
КЛАСС
1) амины
2) спирты
3) аминокислоты
4) нитросоединения
5) альдегиды
6) карбоновые кислоты
Двойная связь С=O содержится в молекулах:
1. стирола
2. изопрена
3. этаналя
4. фенола
5. пропанона
Из предложенного перечня выберите все вещества, с которыми взаимодействует бутановая кислота.
1) Cu
2) Cl2
3) CH3OH
4) CH3OCH3
5) C6H5CH3
Из предложенного перечня выберите два вещества, с которыми реагирует пропиламин.
1. вода
2. хлороводород
3. водород
4. железо
5. гидроксид алюминия
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) бензол и хлор (АlСl3)
Б) циклопропан и водород
В) бензол и хлор (УФ)
Г) толуол и водород
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) пропен
2) пропан
3) хлорбензол
4) гексахлорциклогексан
5) ксилол
6) метилциклогексан
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) фенол и натрий
Б) фенол и сода
В) фенол и бромная вода
Г) уксусная кислота и сода
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) трибромфенол
2) ацетат натрия
3) формиат натрия
4) фенолят натрия
5) монобромфенол
6) бензоат натрия
В заданной схеме превращений
[math]CH_3OH\xrightarrow XHCOH\xrightarrow Y(NH_4)_2CO_3[/math]
веществами X и Y соответственно являются:
1. CuO
2. Cu(OH)2
3. NH3
4. CO2
5. Ag2O (NH3 • H2O)
Из предложенного перечня реакций выберите все обратимые реакции:
1. Na2CO3 + H2O = NaOH + NaHCO3
2. Zn + 2HCl = H2 + ZnCl2
3. 2SO2 + O2 = 2SO3
4. 3H2 + N2 = 2NH3
5. Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Из предложенного перечня выберите все воздействия, которые увеличивают скорость реакции разложения аммиака на простые вещества:
1. Повышение давления
2. Повышение температуры
3. Добавление катализатора
4. Уменьшение объема сосуда
5. Повышение концентрации азота
Установите соответствие между уравнением реакции и формулой вещества, являющегося восстановителем в данной реакции: к каждой, позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ
А) 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Б) 3CuO + 2NH3 = 3Cu + N2 + 3H2O
В) 4NO2 + O2 + 2H2O = 4HNO3
ВОССТАНОВИТЕЛЬ
1) NH3
2) Cu
3) HNO3
4) NO2
5) CuO
Установите соответствие между формулой соли и продуктами электролиза её водного раствора, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЛИ
А) Ba(NO3)2
Б) Аl2(SO4)3
В) КNO3
Г) СuСl2
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
1) водород и кислород
2) металл и кислород
3) водород и галоген
4) металл и галоген
5) металл и водород

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке убывания значения pH их водных растворов.
1) Иодид марганца (II)
2) Перманганат калия
3) Иодоводород
4) Силикат натрия
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении температуры в системе.
УРАВНЕНИЕ РЕАКЦИИ
А) C2H6 [math]\rightleftarrows[/math] C2H4(г) + H2(г)
Б) 2SO2(г) + O2(г) [math]\rightleftarrows[/math] 2SO3(г)
В) 2NH3(г) [math]\rightleftarrows[/math] N2(г) + 3H2(г)
Г) N2(г) + O2(г) [math]\rightleftarrows[/math] 2NO(г)
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили хлор и трифторид хлора. При этом исходные концентрации трифторида хлора и хлора составляли 0,5 моль/л и 0,35 моль/л соответственно. В результате протекания обратимой реакции ClF3 (г.) + Сl2 (г.) ⇋ 3ClF (г.) в реакционной системе установилось химическое равновесие, при котором концентрация трифторида хлора составила 0,30 моль/л. Определите равновесные концентрации Cl2 (X) и ClF (Y).
Выберите из списка номера правильных ответов.
1) 0,20 моль/л
2) 0,25 моль/л
3) 0,30 моль/л
4) 0,35 моль/л
5) 0,40 моль/л
6) 0,45 моль/л
Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА
А) НСl + Na2CO3
Б) СаСl2 + Na2CO3
В) Са(НСO3)2 + Са(ОН)2
Г) Са(НСO3)2 + NaOH
ПРИЗНАКИ РЕАКЦИИ
1) выделение бесцветного газа
2) образование черного осадка
3) образование белого осадка
4) изменение окраски раствора
5) видимых признаков не наблюдается
Для обнаружения ацетальдегида можно использовать:
1. гидроксид меди(I)
2. гидроксид меди(II)
3. аммиачный раствор оксида серебра
4. серную кислоту
5. фенолфталеин
Упариванием 500 г раствора с массовой долей соли 10% получен раствор с массовой долей соли 14%. Какова масса выпаренной при этом воды? (Запишите число с точностью до целых.)
Ответ: ___________________г.
Какой объём газа (н.у.) не вступит в реакцию, если сжигать 50 л водорода в 50 л кислорода? (Запишите число с точностью до целых.)
Ответ: ___________________л.
Образец оксида меди(II), содержащий в качестве примеси 5,7% меди, поместили в соляную кислоту. На растворение оксида меди(II) из указанного образца потребовалось 146 г хлороводорода. Вычислите массу нерастворившегося осадка меди. (Запишите число с точностью до десятых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Ацетат калия, соляная кислота, перманганат калия, хлорид кальция, пероксид водорода, силикат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. Реакция протекает с изменением цвета раствора, выделяется газ жёлто-зелёного цвета. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
1) Написано уравнение реакции
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 8H2O + 5Cl2
2) Указан электронный баланс
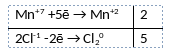
3) Указано, что марганец в степени окисления +7 (перманганат калия) является окислителем, а хлор в степени окисления -1 (соляная кислота) является восстановителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции образуется нерастворимый гидроксид. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
K2SiO3 + 2HCl = H2SiO3 + 2KCl
2) Написано полное ионное уравнение:
2K+ + SiO32- + 2H+ + 2Cl- = H2SiO3 + 2K+ + 2Cl-
3) Написано сокращённое ионное уравнение:
SiO32- + 2H+= H2SiO3
Нитрат калия нагрели с порошкообразным свинцом до прекращения реакции. Смесь продуктов обработали водой, а затем полученный раствор профильтровали. Фильтрат подкислили серной кислотой и обработали иодидом калия. Выделившееся простое вещество нагрели с концентрированной азотной кислотой. В атмосфере образовавшегося при этом бурого газа сожгли красный фосфор.
Запишите уравнения описанных реакций.
1) KNO3 + Pb 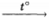 KNO2 + PbO
KNO2 + PbO
2) 2KNO2 + 2H2SO4 + 2KI = 2K2SO4 + 2NO↑ + I2 + 2H2O
3) I2 + 10HNO3 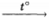 2HIO3 + 10NO2↑ + 4H2O
2HIO3 + 10NO2↑ + 4H2O
4) 10NO2 + 8P = 4P2O5 + 5N2
Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
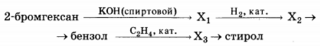
При написании уравнений реакций используйте структурные формулы органических соединений.
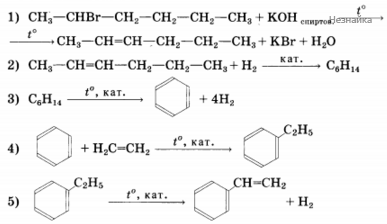
Некоторое органическое соединение, помимо углерода и водорода, содержит азот, массовая доля которого 23,7%.. Это соединение обладает нециклическим строением, взаимодействует с соляной кислотой с образованием соли, молекула его содержит два углеводородных радикала. На основании этих данных:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) приведите уравнение реакции его взаимодействия с соляной кислотой.
2) молекулярная формула C3H9N
3) структурная формула
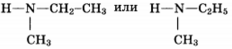
4) уравнение реакции (CH3)(C2H5)NH + HCl → (CH3)(C2H4)NH2+ Cl-
Смесь меди и оксида меди (I) растворили в избытке концентрированной азотной кислоты. При этом образовалось 470 г раствора, в котором массовая доля соли составила 40%. Соль выделили из раствора, а оставшийся раствор нейтрализовали гидроксидом натрия. Известно, что соотношение масс меди, оксида меди (I) и гидроксида натрия составляет 8 : 9 : 20. Определите массовую долю азотной кислоты в исходном растворе.
Элементы ответа:
Записаны уравнения реакций:
(1) Cu + 4HNO3 = Cu(NO3)2 + 2NO2 ↑ + 2H2O
(2) Cu2O + 6HNO3 = 2Cu(NO3)2 + 2NO2 ↑ + 3H2O
(3) NaOH + HNO3 = NaNO3 + H2O
Вычислено количество исходных веществ
m(Cu(NO3)2) = m(p-pa) • ω = 470 • 0,4 = 188 г
n общ.(Cu(NO3)2) = m : M = 188 : 188 = 1 моль
Пусть n(Cu) = n1(Cu(NO3)2) = x моль, тогда
n(Cu2O) = n2(Cu(NO3)2) : 2 = (1 − x) : 2 = 0,5 − 0,5х моль
m(Cu) = M • n = 64x г
m(Cu2O) = M • n = 144 • (0,5 − 0,5х) = 72 − 72х г
m(Cu) : m(Cu2O) = 8 : 9, отсюда 64x : (72 − 72х) = 8 : 9
х = 0,5 моль
n(Cu) = 0,5 моль, n(Cu2O) = (1 − 0,5) : 2 = 0,25 моль
m(Cu) = M • n = 64 • 0,5 = 32 г
m(Cu2O) = M • n = 144 • 0,25 = 36 г
m(Cu) : m(NaOH) = 8 : 20, отсюда 32 : y = 8 : 20
y = 80 г
n(NaOH) = m : M = 80 : 40 = 2 моль
Вычислена масса раствора азотной кислоты
m (конеч. р-ра) = m(Cu) + m(Cu2O) + mp-pa(HNO3) – m(NO2) = 470 г
m p-pa(HNO3) = m(конеч. р-ра) − m(Cu) − m(Cu2O) + m(NO2)
m p-pa(HNO3) = 470 − 32 − 36 + (0,5 • 2 + 0,25 • 2) • 46 = 471 г
Вычислена массовая доля азотной кислоты в исходном растворе
n исх.(HNO3) = n(Cu) • 4 + n(Cu2O) • 6 + n(NaOH)
n исх.(HNO3) = 0,5 • 4 + 0,25 • 6 + 2 = 5,5 моль
m исх.(HNO3) = M • n = 63 • 5,5 = 346,5 г
ω (HNO3) = 346,5 : 471 • 100% = 73,57%
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||