Вариант 4
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Определите, атомы каких из указанных в ряду элементов имеют в основном состоянии два неспаренных электрона. Запишите в поле ответа номера выбранных элементов.
1) Na
2) N
3) Si
4) Р
5) С
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их атомного радиуса.
1) C
2) Cr
3) Cu
4) Be
5) N
Из указанных в ряду элементов выберите два элемента, для которых наибольшая степень окисления равна +6.
1) O
2) S
3) Cr
4) C
5) P
Из предложенного перечня веществ выберите два вещества молекулярного строения, которые содержат только ковалентные полярные связи.
1)Оксид кремния (IV)
2)Метан
3)Хлорид аммония
4)Пероксид водорода
5)Иодоводород
Среди предложенных названий веществ, расположенных в пронумерованных ячейках, выберите названия: А) кислоты, Б) оксида, В) комплексной соли.
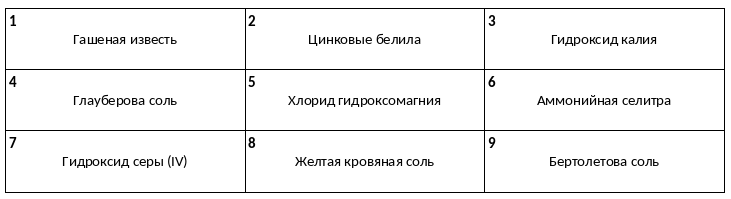
Даны две пробирки с раствором гидроксида натрия. В одну из двух пробирок добавили нерастворимое в воде вещество Х. В результате добавленное вещество полностью растворилось. В другую пробирку добавили раствор вещества Y. В результате реакции выделился газ с резким запахом. Из предложенного перечня выберите вещества Х и Y, которые участвовали в описанных реакциях.
1) оксид магния
2) оксид алюминия
3) карбонат бария
4) ацетат магния
5) ацетат аммония
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) NH4I
Б) HNO3 (конц.)
В) HCl
Г) Fe2O3
РЕАГЕНТЫ
1) K2[Zn(OH)4], S, Fe3O4
2) K2S, Br2, Zn
3) KOH, Cl2, KNO2
4) AgNO3, CaCO3, K2CrO4
5) Na2CO3, H2, H2SO4
Установите соответствие между исходными веществами и продуктами их взаимодействия.
ИСХОДНЫЕ ВЕЩЕСТВА
А) Na2CO3 + Н3РO4 →
Б) Na2CO3 + Н2СO3 →
В) Na3PO4 + Н2СO3 →
Г) Na + Н3РO4 →
ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
1) Na3PO4 + Н2O + СO2
2) Na2HPO4 + Na2CO3
3) Na3PO4 + Н2
4) NaH2PO4 + Н2
5) NaHCO3
6) Na2HPO4 + H2O + CO2
В заданной схеме превращений
[math]Ca(H_2PO_4)_2\xrightarrow XCa_3(PO_4)_2\xrightarrow YP_4[/math]
веществами X и Y соответственно являются:
1. Ca(OH)2
2. Н2O
3. Ca
4. C
5. H2SO4
Установите соответствие между формулой органического соединения и его названием.
ФОРМУЛА СОЕДИНЕНИЯ
А) СН3—ОН
Б) С6Н5—СН=СН2
В) СН2(OН)—СН2(OН)
Г) CH2=CH—CH=CH2
НАЗВАНИЕ СОЕДИНЕНИЯ
1) дивинил
2) метанол
3) изопрен
4) этандиол
5) толуол
6) стирол
Гомологами являются:
1. изобутан и 2-метилпентан
2. стирол и пропанол-2
3. этилбензол и о-ксилол
4. этанол и пропанол-1
5. муравьиная и акриловая кислоты
Из предложенного перечня выберите все исходные вещества, в результате взаимодействия которых образуется этан.
1) C2H4 и H2
2) CH3Cl и H2
3) CH3COONa и H2O (электролиз)
4) CaC2 и H2O
5) CH3COONa и NaOH (сплавление)
Из предложенного перечня выберите два вещества, с которыми реагирует аминоуксусная кислота, но не реагирует метиламин.
1. уксусная кислота
2. водород
3. кислород
4. аммиак
5. кальций
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) толуол и хлор (FeCl3)
Б) толуол и хлор (свет)
В) бензол и водород
Г) бензол и хлорметан
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) хлористый бензил
2) циклогексан
3) толуол
4) метилгексахлорциклогексан
5) ксилол
6) хлортолуол
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CH3COOK и КОН
Б) СН3СООН и СН3ОН
В) СН3ОН и К
Г) СН3ОН и H2SO4
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) диэтиловый эфир
2) метилацетат
3) метилат калия
4) метан
5) диметиловый эфир
6) метаналь
В заданной схеме превращений
фенолят натрия [math]\xrightarrow X[/math] фенол [math]\xrightarrow Y[/math] пикриновая кислота
веществами X и Y соответственно являются:
1. H2
2. HCl
3. KOH
4. HNO3
5. KNO3
Из предложенного перечня типов реакций выберите все типы реакций, к которым можно отнести взаимодействие азота и водорода.
1. необратимая
2. каталитическая
3. обратимая
4. реакция замещения
5. окислительно-восстановительная
Из предложенного перечня выберите все воздействия, которые ускоряют реакцию:
2H2O2 (р-р) = 2H2O (ж) + O2 (г) + Q.
1. Понижение внешнего давления
2. Понижение температуры
3. Повышение концентрации пероксида водорода
4. Добавление воды
5. Добавление MnO2
Установите соответствие между формулой иона и окислительно-восстановительными свойствами, которые этот ион может проявлять: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ИОНА
А) Hg2+
Б) Cr3+
В) N3-
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА
1) не проявляет окислительно-восстановительных свойств
2) и окислитель и восстановитель
3) только окислитель
4) только восстановитель
Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества.
ФОРМУЛА ВЕЩЕСТВА
А) NaF
Б) Hg(NO3)2
В) FeCl2
Г) KHSO4
АНОДНЫЙ ПРОДУКТ
1) кислород
2) металл
3) водород
4) сера
5) фтор
6) хлор

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке возрастания значения pH их водных растворов.
1) (NH4)2SO4
2) H2SO4
3) K2SO3
4) Na2SO4
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при уменьшении давления в системе:
УРАВНЕНИЕ РЕАКЦИИ
А) SO2Cl2(г) [math]\rightleftarrows[/math] SO2(г) + Cl2(г)
Б) 2SO2(г) + O2(г) [math]\rightleftarrows[/math] 2SO3(г)
В) 2HI(г) [math]\rightleftarrows[/math] H2(г) + I2(тв.)
Г) S(г) + H2(г) [math]\rightleftarrows[/math] H2S(г)
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили некоторое количество фторида хлора(I). В результате протекания обратимой реакции 3ClF (г.) ⇋ ClF3 (г.) + Cl2 (г.) в реакционной системе установилось химическое равновесие, при котором концентрации фторида хлора(I) и хлора составили 0,2 моль л и 0,1 моль/л соответственно. Определите исходную концентрацию ClF (X) и равновесную концентрацию ClF3 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА
А) СН3СООН + NaOH
Б) Zn(OH)2 + КОН (р-р)
В) КМnO4 + H2S
Г) АlСl3 + AgNO3
ПРИЗНАКИ РЕАКЦИИ
1) растворение осадка
2) образование осадка
3) изменение окраски раствора
4) выделение газа
5) видимых признаков реакции нет
На открытом пламени горелки нельзя нагревать колбу с:
1. 15%-ным раствором серной кислоты
2. водным раствором уксусной кислоты
3. спиртовым раствором КОН
4. раствором брома в гексане
5. раствором иода в тетрахлорметане
При упаривании 300 г 5%-ного раствора сахарозы получено 245 г раствора. Какова массовая доля сахарозы в нём? (Запишите число с точностью до целых.)
Ответ: ____________________%.
Рассчитайте максимально возможный объём (н.у.) аммиака, который может быть получен исходя из 40 л водорода и 30 л азота. (Запишите число с точностью до десятых.)
Ответ: ____________________л.
При взаимодействии загрязнённого образца гидрокарбоната натрия с гидроксидом натрия образовалось 286,2 г средней соли. Определите массу (г) указанного образца, если известно, что массовая доля посторонних примесей составляет 5%. (Запишите число с точностью до десятых)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Нитрит калия, перманганат калия, серная кислота, гидроксид калия, нитрат аммония, сульфид железа(II). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется раствор зеленого цвета, не выделяется газ и не образуется осадок. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
KNO2 + 2KMnO4 + 2KOH = KNO3 + 2K2MnO4 + H2O2) Указан электронный баланс
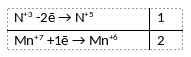
3) Указано, что азот в степени окисления +3 (нитрит калия) является восстановителем, а марганец в степени окисления +7 (перманганат калия) является окислителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе реакции образуется слабое основание. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
NH4NO3 + KOH = KNO3 + NH3∙H2O
2) Написано полное ионное уравнение:
NH4+ + NO3- + K+ + OH- = K+ + NO3- + NH3∙H2O
3) Написано сокращённое ионное уравнение:
NH4+ + OH- = NH3∙H2O
Карбид алюминия полностью растворили в бромоводородной кислоте.
К полученному раствору добавили раствор сульфита калия, при этом наблюдали образование белого осадка и выделение бесцветного газа. Газ поглотили раствором дихромата калия в присутствии серной кислоты. Образовавшуюся соль хрома выделили и добавили к раствору нитрата бария, наблюдали выделение осадка.
Напишите уравнения четырёх описанных реакций.
1) [math]Al_4C_3+12HBr=4AlBr_3+3CH_4\uparrow[/math]
2) [math]2AlBr_3+3K_2SO_3+3H_2O=2Al(OH)_3\downarrow+3SO_2\uparrow+6KBr[/math]
3) [math]3SO_2+K_2Cr_2O_7+H_2SO_4=Cr2(SO_4)_3+K_2SO_4+H_2O[/math]
4) [math]Cr_2(SO_4)_3+3Ba(NO_3)_2=3BaSO_4\downarrow+2Cr(NO_3)_3[/math]
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
ацетат натрия [math]\rightarrow[/math] метан [math]\xrightarrow{1\;моль\;Cl_2,свет}X_1\xrightarrow{NaOH_{(водн)},t^\circ}X_2\rightarrow[/math] метаналь[math]\xrightarrow{KMnO_4,\;H_2SO_4}X_3[/math]При написании уравнений реакций используйте структурные формулы органических веществ.
Ответ включает в себя 5 уравнений реакций, соответствующих схеме превращений:
1) [math]CH_3COONa+NaOH\xrightarrow{t^\circ}CH_4+Na_2CO_3[/math]
2) [math]CH_4+Cl_2\rightarrow CH_3Cl+HCl[/math]
3) [math]CH_3Cl+NaOH\xrightarrow{t^\circ}CH_3OH+NaCl[/math]
4) [math]CH_3OH+CuO\xrightarrow{t^\circ}CH_2O+Cu+H_2O[/math]
5) [math]\begin{array}{l}5CH_2O+4KMnO_4+6H_2SO_4\rightarrow\\\rightarrow5CO_2+4MnSO_4+2K_2SO_4+11H_2O\end{array}[/math]
При сгорании 4,48 л (н.у.) газообразного органического вещества получили 35,2 г углекислого газа и 10,8 мл воды. Плотность этого вещества составляет 2,41 г/л (н.у.). Известно также, что это вещество не реагирует с аммиачным раствором оксида серебра, а при реакции его с избытком бромной воды происходит присоединение атомов брома только ко вторичным атомам углерода.
На основании данных условия задачи:
1. произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2. запишите молекулярную формулу органического вещества;
3. составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4. напишите уравнение реакции этого вещества с избытком бромной воды.
Элементы ответа:
Общая формула вещества - CxHyOz
1) Найдены количество вещества углекислого газа, воды и органического вещества:
n(CO2) = 35,2 / 44 = 0,8 моль
m(H2O) = 10,8 / 18 = 0,6 моль
M(CxHyOz) = 2,41 x 22,4 = 54 г/моль
n(CxHyOz) = 4,48 / 22,4 = 0,2 моль
2) Определена молекулярная формула вещества:
n(C) = n(CO2) = 0,8 моль
n(H) = 2n(H2) = 1,2 моль
x = n(C) / n(CxHyOz) = 0,8 / 0,2 = 4
y = n(H) / n(CxHyOz) = 1,2 / 0,2 = 6
4 x 12 + 6 + z x 16 = 30
z = 0
Молекулярная формула C4H6
3) Составлена структурная формула вещества:
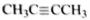
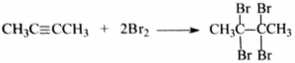
4) Составлено уравнение реакции этого вещества с избытком бромной воды:
Смесь меди и оксида меди (I) массой 42,4 г растворили в 460 г концентрированной серной кислоты. Известно, что количество электронов, суммарно отданных атомами меди в оксиде меди (I) было в 2,5 раза больше, чем количество электронов, отданных атомами меди — простого вещества. Определите массовую долю соли в конечном растворе. (Образованием кислых солей пренебречь).
Элементы ответа:
Записаны уравнения реакций:
(1) Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
(2) Cu2O + 3H2SO4 = 2CuSO4 + SO2 + 3H2O
2. Вычислено количество исходных веществ
(1) Cu0 − 2ē = Cu+2
(2) 2Cu+1 − 2ē = 2Cu+2
n1(ē) : n2(ē) = 1 : 2,5
отсюда n(Cu) : n(Cu2O) = 1 : 2,5
Пусть n(Cu) = x моль, тогда n(Cu2O) = 2,5x моль
64x + 144 · 2,5х = 42,4
х = 0,1
n(Cu) = 0,1 моль, n(Cu2O) = 0,25 моль
3. Вычислена масса сульфата меди (II) в растворе
n1(CuSO4) = n(Cu) = 0,1 моль
n2(CuSO4) = 2 · n(Cu2O) = 2 · 0,25 = 0,5 моль
mобщ(CuSO4) = M · n = 160 · (0,1 + 0,5) = 96 г
4. Вычислена массовая доля сульфата меди (II)
n1(SO2) = n(Cu) = 0,1 моль
n2(SO2) = n(Cu2O) = 0,25 моль
m(общ)(SO2) = n(общ) · M = (0,1 + 0,25) · 64 = 22,4 г
m(конеч. р-ра) = mр-ра(H2SO4) + m(смеси) − m(общ)(SO2)
m(конеч. р-ра) = 460 + 42,4 − 22,4 = 480 г
ω(CuSO4) = 96 : 480 · 100 % = 20 %
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||