Вариант 3
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Один неспаренный электрон на внешнем уровне в основном состоянии имеют атомы:
1. Al
2. C
3. O
4. F
5. Fe
Из указанных в ряду химических элементов выберите три элемента-неметалла. Расположите выбранные элементы в порядке возрастания их атомных радиусов.
1) S
2) Si
3) Ne
4) Al
5) Mg
Из числа указанных в ряду элементов выберите два элемента, которые имеют одинаковую разность между максимальной и минимальной степенями окисления.
1) Be
2) V
3) Ti
4) H
5) S
Выберите два вещества молекулярного строения, в которых содержатся ковалентные неполярные связи.
1)Графит
2)Кристаллическая сера
3)Пероксид натрия
4)Пероксид водорода
5)Метанол
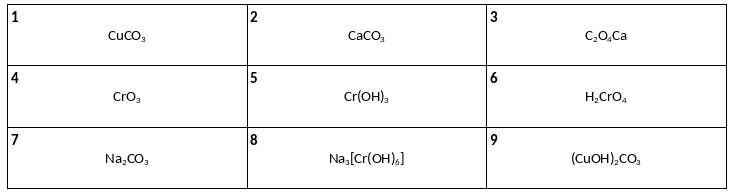
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) малахита Б) кальцинированной соды В) хромового ангидрида.
Даны две пробирки с раствором гидроксида бария. В одну из двух пробирок добавили нерастворимое в воде вещество Х. В результате добавленное вещество полностью растворилось. В другую пробирку добавили раствор вещества Y. В результате произошла реакция, которую описывает сокращённое ионное уравнение
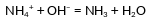
Из предложенного перечня выберите вещества Х и Y, которые участвовали в описанных реакциях.
1) гидроксид магния
2) гидроксид цинка
3) карбонат кальция
4) ацетат аммония
5) сульфат аммония
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Cl2
Б) P2O3
В) SO2
Г) Na2CO3
РЕАГЕНТЫ
1) H2S, NaBr, K2SO3 (р-р)
2) BaSO4, ZnO, HF
3) H2O, KOH, H2SO4 (конц)
4) O2, H2S, Fe2(SO4)3 (р-р)
5) SiO2, CO2 (р-р), АlCl3 (р-р)
Установите соответствие между простыми веществами и формулами реагентов, с которыми они могут взаимодействовать.
ПРОСТОЕ ВЕЩЕСТВО
А) K
Б) Cl2
В) P
Г) H2
ФОРМУЛЫ РЕАГЕНТОВ
1) H2SO4(paзб.), Аl
2) Н2O, KI
3) С2Н4, O2
4) Сu, N2
5) O2, Аl
6) H2SO4(paзб.), S
В заданной схеме превращений
[math]N_2\xrightarrow XMg_3N_2\xrightarrow YNH_3[/math] веществами X и Y соответственно являются:1. Mg(OH)2
2. Mg
3. MgO
4. HCl
5. H2O
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) изобутан
Б) бутен-2
В) пентин-1
Г) транс-пентен-2
ОБЩАЯ ФОРМУЛА
1) CnH2n+2
2) CnH2n
3) CnH2n-2
4) CnH2n-4
5) CnH2n-6
Гомологами являются:
1. дивинил и пентадиен-1,3
2. стирол и толуол
3. толуол и этилбензол
4. этанол и стирол
5. уксусная и олеиновая кислоты
Из предложенного перечня выберите все исходные вещества, в результате взаимодействия которых образуется метан.
1) CH3Cl и Na
2) Al4C3 и H2O
3) CH3COONa и NaOH (сплавление)
4) C2H4 и H2
5) CaC2 и H2O
Из предложенного перечня выберите два вещества, с которыми реагирует диметиламин.
1. Са(ОН)2
2. H2SO4
3. CaC2
4. CH3COOH
5. CH4
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) пропен и хлороводород
Б) ацетилен и водород
В) ацетилен и вода
Г) циклопропан и хлороводород
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) этен
2) этаналь
3) 1-хлорпропан
4) 2-хлорпропан
5) 1,2-дихлопропан
6) хлорциклопропан
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) этилат натрия и вода
Б) этанол и бромоводород
В) уксусная кислота и натрий
Г) уксусная кислота и бром
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) бромуксусная кислота
2) формиат натрия
3) этанол
4) бромэтан
5) бромацетат
6) ацетат натрия
В заданной схеме превращений
[math]C_4H_{10}\xrightarrow XCH_3COOH\xrightarrow YCa(CH_3COO)_2[/math]
веществами X и Y соответственно являются:
1. O2
2. CH3OH
3. Ca(OH)2
4. Ca3(PO4)2
5. CaSO4
Из предложенного перечня типов реакций выберите все типы реакции, к которым можно отнести взаимодействие соляной кислоты и гидроксида натрия.
1. реакция замещения
2. реакция ионного обмена
3. обратимая
4. необратимая
5. окислительно-восстановительная
Из предложенного перечня выберите все воздействия, которые влияют и на скорость реакции, протекающей между водными растворами веществ, и на скорость реакции, протекающей между раствором и твердым веществом:
1. Повышение давления
2. Увеличение площади соприкосновения веществ
3. Разбавление растворов водой
4. Повышение концентрации растворимых реагентов
5. Повышение концентрации продуктов реакции
Установите соответствие между формулой иона и окислительно-восстановительными свойствами, которые этот ион может проявлять: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ИОНА
А) S2-
Б) Cu+
В) SO32-
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА
1) не проявляет окислительно-восстановительных свойств
2) и окислитель, и восстановитель
3) только окислитель
4) только восстановитель
Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества.
ФОРМУЛА ВЕЩЕСТВА
А) К2СO3
Б) AgNO3
В) ZnCl2
Г) NaHC2O4
КАТОДНЫЙ ПРОДУКТ
1) кислород
2) только металл
3) только водород
4) металл и водород
5) азот
6) хлор

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке убывания значения pH их водных растворов.
1) Азотная кислота
2) Гидрокарбонат натрия
3) Гидрокарбонат аммония
4) Уксусная кислота
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе:
УРАВНЕНИЕ РЕАКЦИИ
А) CaCO3(тв.) [math]\rightleftarrows[/math] CaO(тв.) + CO2(г)
Б) 2SO3(г) [math]\rightleftarrows[/math] 2SO2(г) + O2(г)
В) HF(раств.) [math]\rightleftarrows[/math] H+(раств.) + F(раств.)
Г) SO2(г) + Br2(г) [math]\rightleftarrows[/math] SO2Br2(г)
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили некоторое количество оксида хлора(I). В результате протекания обратимой реакции 4Cl2O (г.) ⇋ ЗСl2 (г.) + 2СlО2 (г.) в реакционной системе установилось химическое равновесие, при котором концентрации оксида хлора(I) и оксида хлора(IV) составили 0,05 моль/л и 0,10 моль/л соответственно. Определите исходную концентрацию Сl2О (X) и равновесную концентрацию Cl2 (Y).
Выберите из списка номера правильных ответов.
1) 0,05 моль/л
2) 0,10 моль/л
3) 0,15 моль/л
4) 0,20 моль/л
5) 0,25 моль/л
6) 0,30 моль/л
Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА
А) CuSO4 и КОН
Б) CuSO4 и Na2S
В) Сu(ОН)2 и H2SO4
Г) Сu(ОН)2 и HNO3
ПРИЗНАКИ РЕАКЦИИ
1) выделение бурого газа
2) образование белого осадка
3) образование синего осадка
4) образование черного осадка
5) растворение осадка
К наиболее ядовитым газам относятся:
1. N2
2. Cl2
3. Ar
4. H2S
5. H2
Какова масса уксусной кислоты в растворе, полученном при смешивании 155 г 5%-ного и 207 г 11%-ного растворов кислоты? (Запишите число с точностью до десятых.)
Ответ: ___________________г.
В результате реакции, термохимическое уравнение которой
2Н2(г) + O2(г) = 2Н2O(г) + 484 кДж,
выделилось 121 кДж теплоты. Какой объём (н.у.) кислорода израсходован на сжигание водорода? (Запишите число с точностью до десятых.)
Ответ: ____________________л.
На растворение природного известняка был затрачен раствор, содержащий 167,9 г хлороводорода. При этом осталось 24 г не растворившегося в кислоте осадка. Вычислите массовую долю (%) нерастворимых в кислоте примесей в указанном известняке. (Запишите число с точностью до десятых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Силикат калия, нитрит натрия, дихромат натрия, серная кислота, бромид натрия, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе реакции образуется простое вещество и две соли. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
6NaBr + Na2Cr2O7 + 7H2SO4 = 3Br2 + Cr2(SO4)3 + 4Na2SO4 + 7H2O
2) Указан электронный баланс
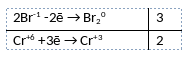
3) Указано, что бром в степени окисления -1 (бромид натрия) является восстановителем, а хром в степени окисления +6 (дихромат натрия) является окислителем.
Из предложенного перечня веществ выберите вещества, которые вступают между собой в реакцию ионного обмена. В ходе этой реакции образуется осадок. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
K2SiO3 + H2SO4 = H2SiO3 + K2SO4
2) Написано полное ионное уравнение:
2K+ + SiO32- + 2H+ + SO42- = H2SiO3 + 2K+ + SO42-3) Написано сокращённое ионное уравнение:
SiO32- + 2H+ = H2SiO3
Железную окалину растворили в концентрированной азотной кислоте.
К полученному раствору добавили раствор гидроксида натрия. Выделившийся осадок отделили и прокалили. Образовавшийся твёрдый остаток сплавили с железом.
Напишите уравнения четырёх описанных реакций.
Элементы ответа:
1) [math]Fe_3O_4+10HNO_3=3Fe(NO_3)_3+NO_2+5H_2O[/math]
2) [math]Fe(NO_3)_3+3NaOH=3NaNO_3+Fe(OH)_3\downarrow[/math]
3) [math]2Fe(OH)_3=Fe_2O_3+3H_2O[/math] (при нагревании)
4) [math]Fe_2O_3+Fe=3FeO[/math] (при нагревании)
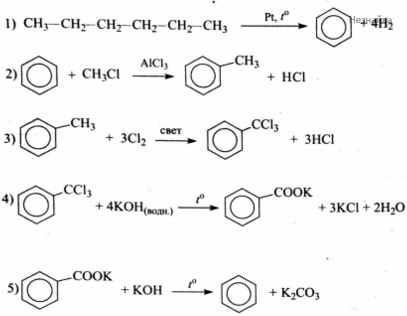
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
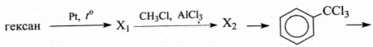
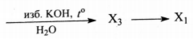
При написании уравнений реакций используйте структурные формулы органических веществ.
Хлорид фосфора(V) массой 4,17 г полностью прореагировал с водой. Какой объём раствора гидроксида калия с массовой долей 10% (плотностью 1,07 г/мл) необходим для полной нейтрализации полученного раствора?
Элементы ответа:
1) Записаны уравнения реакций гидролиза хлорида фосфора и нейтрализации двух кислот:
PCl5 + 4H2O = H3PO4 + 5HCl
H3PO4 + 3KOH = K3PO4 + 3H2O
HCl + KOH = KCl + H2O
2) Рассчитаны количество вещества хлорида фосфора (V) и кислот, образовавшихся при гидролизе:
n(PCl5) = 4,17 / 208,5 = 0,02 моль
n(H3PO4) = n(PCl5) = 0,02 моль
n(HCl) = 5n(PCl5) = 0,1 моль
Смесь фосфора и оксида фосфора (III) общей массой 61,2 г растворили в концентрированной азотной кислоте массой 400 г. Известно, что количество электронов, суммарно отданных атомами фосфора в оксиде фосфора (III) было в 2 раза больше, чем количество электронов, отданных атомом фосфора — простого вещества. Вычислите массовую долю фосфорсодержащего вещества в полученном растворе.
Элементы ответа:
1. Записаны уравнения реакций:
(1) P + 5HNO3 (конц) = Н3PO4 + 5NO2 + H2O
(2) P2O3 + 4HNO3 (конц) + H2O = 2H3PO4 + 4NO2
2. Вычислено количество исходных веществ
P0 − 5ē = P+5
2P+3 − 4ē = 2P+5
Пусть n(P) = x моль, а n(P2O3) = y моль;
тогда n1(ē) = 5x моль и n2(ē) = 4y моль
n2(ē) : n1(ē) = 4y : 5x = 2 : 1, отсюда y = 2,5х
31x + 110 · 2,5х = 61,2
х = 0,2
n(P) = 0,2 моль
n(P2O3) = 0,2 · 2,5 = 0,5 моль
3. Вычислена масса фосфорной кислоты в растворе
n1(Н3PO4) = n(P) = 0,2 моль
n2(Н3PO4) = 2 · n(P2O3) = 2 · 0,5 = 1 моль
mобщ(Н3PO4) = M · n = 98 · (1 + 0,2) = 117,6 г
4. Вычислена массовая доля фосфорной кислоты в растворе
n1(NO2) = 5 · n(P) = 5 · 0,2 = 1 моль
n2(NO2) = 4 · n(P2O3) = 4 · 0,5 = 2 моль
m(общ)(NO2) = n · M = (1 + 2) · 46 = 138 г
m(конеч. р-ра) = m(р-ра)(HNO3) + m(смеси) − m(NO2)
m(конеч. р-ра) = 400 + 61,2 − 138 = 323,2 г
ω (Н3PO4) = 117,6 : 323,2 · 100 % = 36,39 %
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||