Вариант 2
Часть 1.
Ответом к заданиям 1–25 является последовательность цифр. Цифры в ответах на задания 7, 8, 10, 14, 15, 19, 20, 22, 24 могут повторяться.
Одинаковое число неспаренных электронов на внешнем уровне в основном состоянии имеют частицы:
1. Li
2. Br7+
3. N
4. C
5. Al
Из указанных в ряду химических элементов выберите 3 p-элемента. Расположите выбранные элементы в порядке уменьшения их атомного радиуса.
1) Cs
2) C
3) O
4) Cr
5) N
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях проявляют постоянную степень окисления.
1) Al
2) Si
3) Mg
4) C
5) N
Из предложенного перечня выберите два вещества, для которых в твердом состоянии характерны свойства: растворимы в воде, не проводят электрический ток, тугоплавкие.
1)Карборунд
2)Хлорид калия
3)Гидроксид натрия
4)Ванадий
5)Фенол
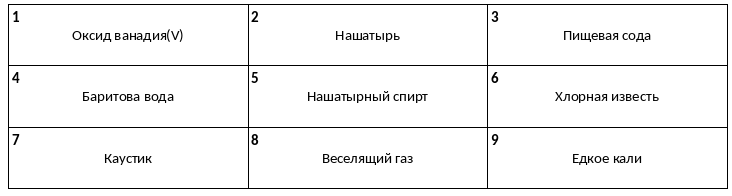
Среди предложенных названий веществ, расположенных в пронумерованных ячейках, выберите названия: А) кислотного оксида, Б) несолеобразующего оксида, В) средней соли.
В одну пробирку с раствором гидроксида натрия добавили раствор вещества Х и в результате реакции наблюдали выпадение осадка бeлoгo цвета. В другую пробирку с раствором гидроксида натрия добавили раствор вещества Y, при этом наблюдали сначала образование осадка, а затем его растворение. Из предложенного перечня выберите вещества Х и Y, которые участвовали в описанных реакциях.
1) ZnBr2
2) Al(OH)3
3) NaHSO4
4) Са(НСО3)2
5) K2[Zn(OH)4]
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) Br2
Б) HCl
В) Ba(OH)2
Г) KI
РЕАГЕНТЫ
1) Zn, Na2O, MnO2
2) FeSO4, CO2, P
3) AgNO3, H2O2, CuSO4
4) Na2SO3 (р-р), H2, NaOH
5) KOH, O2, CO2
Установите соответствие между веществами и формулами реагентов, с которыми они могут взаимодействовать.
ВЕЩЕСТВО
А) NaHSO4
Б) K2SO4
В) Li
Г) O2
ФОРМУЛЫ РЕАГЕНТОВ
1) H2SO4, ВаСl2, Pb(NO3)2
2) N2, H2SO4, O2
3) N2, Ag, HCl
4) N2, Pt, NH3
5) SO2, P2O3, CrO
6) KOH, CH3COONa, NaOH
В заданной схеме превращений
[math]N_2\xrightarrow XCa_3N_2\xrightarrow YNH_3[/math]
веществами X и Y соответственно являются:
1. Са
2. СаО
3. Н2О
4. НСl
5. H2SO4
Установите соответствие между формулой соединения и классом, к которому это соединение принадлежит.
ФОРМУЛА СОЕДИНЕНИЯ
А) С2Н4O2
Б) C6H7N
В) C2H6O
Г) С3Н6O
КЛАСС
1) карбоновые кислоты
2) аминокислоты
3) амины
4) спирты
5) нитросоединения
6) альдегиды
Атомы углерода только в sp3-rибридном состоянии находятся в молекулах
1. изопрена
2. изобутана
3. пропанола-1
4. толуола
5. уксусной кислоты
Из предложенного перечня выберите все исходные вещества, в результате взаимодействия которых образуется н-бутан.
1) C4H8 и H2
2) C4H9NO2 и H2
3) C2H5COOK и H2О (электролиз)
4) C2H5Cl и Na
5) CH2Br–CH2–CH2–CH2Br и Zn
Из предложенного перечня выберите два вещества, с которыми реагирует глицин.
1. этан
2. пропен
3. пропанол-1
4. бромоводород
5. бензол
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) метан (изб.) и хлор
Б) ацетилен и водород
В) пропан и бром
Г) циклопропан и водород
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) тетрахлорметан
2) хлорметан
3) этан
4) 1-бромпропан
5) 2-бромпропан
6) пропан
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) этанол и натрий
Б) этанол и бромоводород
В) этан и бром
Г) этанол и метанол
ПРОДУКТ ВЗАИМОДЕЙСТВИЯ
1) этилнатрий
2) этилат натрия
3) бромэтан
4) бромэтен
5) мети л этанол
6) метилэтиловый эфир
В заданной схеме превращений
[math]HCOH\xrightarrow XCH_3OH\xrightarrow YCH_3OCH_3[/math]
веществами X и Y соответственно являются:
1. H2
2. Ca(OH)2
3. CuO
4. CO2
5. H2SO4
Из предложенного перечня схем реакций выберите все схемы, соответствующие эндотермическим реакциям.
1. CaCO3 →
2. Fe + Cl2 →
3. N2 + O2 →
4. H2O →
5. C6H6 + O2 →
Из предложенного перечня выберите схемы тех реакций, которые протекают при комнатной температуре с гораздо большей скоростью, чем остальные.
1. FeSO4 (р-р) + NaOH (р-р) →
2. N2 (г) + O2 (г) →
3. Fe (тв) + HNO3 (конц) →
4. NH3 (р-р) + HCl (р-р) →
5. Fe (тв) + S (тв) →
Установите соответствие между схемой реакции и свойством азота, которое этот элемент проявляет в данной реакции. К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ
А) NH3 + O2 → NO + H2O
Б) CaO + HNO3 → Ca(NO3)2 + H2O
В) N2O5 → O2 + NO2
СВОЙСТВО АЗОТА
1) только окислитель
2) только восстановитель
3) и окислитель, и восстановитель
4) ни окислитель, ни восстановитель
Установите соответствие между формулой соли и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества.
ФОРМУЛА СОЛИ
А) Na2HPO4
Б) SnCl2
В) BeF2
Г) SnBr4
АНОДНЫЙ ПРОДУКТ
1) кислород
2) галоген
3) водород
4) фосфор

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке возрастания значения pH их водных растворов.
1) Иодоводородная кислота
2) Хлорид аммония
3) Аммиак
4) Перхлорат бария
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе.
УРАВНЕНИЕ РЕАКЦИИ
А) C(тв.) + CO2(г) [math]\rightleftarrows[/math] 2CO(г)
Б) C(тв.) + 2H2(г) [math]\rightleftarrows[/math] CH4(г)
В) HNO2 (р-р) [math]\rightleftarrows[/math] H+(р-р) + NO2 -(р-р)
Г) 2NO2(г) [math]\rightleftarrows[/math] 2NO(г) + O2(г)
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
В реактор постоянного объёма поместили азот и фтор. При этом исходная концентрация фтора составляла 1,2 моль/л. В результате протекания обратимой реакции N2 (г.) + 3F2 (г.) ⇋ 2NF3 (г.) в реакционной системе установилось химическое равновесие, при котором концентрации азота и трифторида азота составили 0,2 моль/л и 0,4 моль/л соответственно. Определите исходную концентрацию N2 (X) и равновесную концентрацию F2 (Y).
Выберите из списка номера правильных ответов.
1) 0,1 моль/л
2) 0,2 моль/л
3) 0,3 моль/л
4) 0,4 моль/л
5) 0,5 моль/л
6) 0,6 моль/л
Установите соответствие между веществами и реагентом, с помощью которого их можно отличить друг от друга.
ВЕЩЕСТВА
А) КОН(р-р) и НСООН(р-р)
Б) СаВr2(тв.) и CaF2(тв.)
В) Аl(ОН)3(тв.) и АlСl3(тв.)
Г) Na2S(p-p) и Na3PO4(р-р)
РЕАГЕНТ
1) дистиллированная вода
2) AgNO3
3) фенолфталеин
4) Н3РO4
5) ацетальдегид
Колонна синтеза используется в процессах получения
1. серной кислоты
2. метанола
3. аммиака
4. железа из руды
5. бензина из нефти
Сколько граммов воды следует добавить к 300 г 22%-ного раствора уксусной кислоты, чтобы получить 9%-ный раствор? (Запишите число с точностью до целых.)
Ответ: ____________________г.
Какой объём азота (н.у.) образуется при полном сгорании 20 л аммиака в избытке кислорода? (Запишите число с точностью до целых.)
Ответ:______ л.
Из 3,5 кг технического карбоната натрия получили 3510 г хлорида натрия. Вычислите массовую долю (%) карбоната натрия в указанном образце. (Запишите число с точностью до целых.)
Часть 2.
Для записи ответов на задания 29–34 используйте БЛАНК ОТВЕТОВ. Запишите сначала номер задания (29, 30 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 29 и 30 используйте следующий перечень веществ:
Нитрат магния, гидросульфат натрия, оксид меди(I), пероксид водорода, гидроксид хрома(III), серная кислота (разбавл.). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ходе этой реакции происходит растворение твёрдого вещества и появляется голубая окраска раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Элементы ответа:
1) Написано уравнение реакции
Cu2O + H2O2 + 2H2SO4 = 2CuSO4 + 3H2O
2) Указан электронный баланс
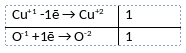
3) Указано, что медь в степени окисления +1 (или оксид меди(I)) является восстановителем, а кислород в степени окисления -1 (или пероксид водорода) является окислителем.
Из предложенного перечня веществ выберите сильный электролит и вещество, которое вступает с ним в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Элементы ответа:
1) Написано молекулярное уравнение:
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
2) Написано полное ионное уравнение:
2Cr(OH)3 + 6H+ + 3SO42- = 2Cr3+ + 3SO42- + 6H2O
3) Написано сокращённое ионное уравнение:
Cr(OH)3 + 3H+ = Cr3++ 3H2O
Иодоводородную кислоту нейтрализовали гидрокарбонатом калия. Полученная соль прореагировала с раствором, содержащим дихромат калия и серную кислоту. При взаимодействии образовавшегося простого вещества с алюминием получили соль. Эту соль растворили в воде и смешали с раствором сульфида калия, в результате чего образовался осадок и выделился газ.
Напишите уравнения четырёх описанных реакций.
Элементы ответа:
написаны четыре уравнения описанных реакций:
1) [math]KHCO_3+HI=KI+H_2O+CO_2\uparrow[/math]
2) [math]K_2Cr_2O_7+6KI+7H_2SO_4=Cr_2(SO_4)_3+3I_2+4K_2SO_4+7H_2O[/math]
3) [math]2Al+3I_2=2AlI_3[/math]
4) [math]2AlI_3+3K_2S+6H_2O=2Al(OH)_3\downarrow+3H_2S\uparrow+6KI[/math]
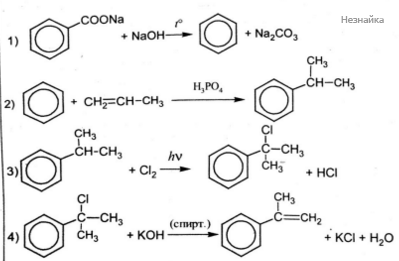
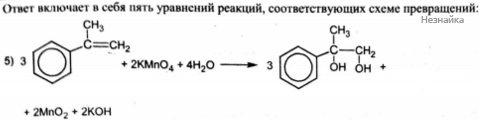
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
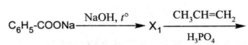
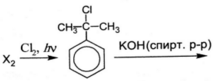
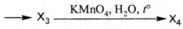
При написании уравнений реакций используйте структурные формулы органических веществ.
При взаимодействии 5,6 г гидроксида калия с 5,0 г хлорида аммония получили аммиак. Его растворили в 50 г воды. Определите массовую долю аммиака в полученном растворе. Определите объём 10%-ного раствора азотной кислоты с плотностью 1,06 г/мл, который потребуется для нейтрализации аммиака.
Элементы ответа:
1) Записаны уравнения реакций:
KOH + NH4Cl = KCl + NH3 + H2O
NH3 + HNO3 = NH4NO3
2) Рассчитаны количество вещества щелочи и хлорида аммония, и сделан вывод об избытке щелочи:
n(KOH) = 5,6 / 56 = 0,1 моль, n(NH4Cl) = 5 / 53,5 = 0,093 моль - щелочь в избытке, расчет ведем по хлориду аммония.
3) Найдены масса аммиака и массовая доля его в растворе:
n(NH3) = n(NH4Cl) = 0,093 моль
m(NH3) = 0,093 x 17 = 1,58 г
ѡ(NH3) = 1,58 / 51,58 = 0,0306, или 3,06%
4) Рассчитан объем раствора кислоты:
n(HNO3) = n(NH3) = 0,093 моль
m(HNO3) = 0,093 x 63 = 5,86 г
m(p-pa) (HNO3) = 5,86 / 0,1 = 58,6 г
V(HNO3) = 58,6 / 1,06 = 55,3 мл
Смесь железа и железной окалины массой 144,8 г полностью прореагировала с 900 г раствора концентрированной азотной кислоты. Известно, что количество отданных электронов атомом железа в железной окалине было в 2 раза больше, чем количество электронов, отданных атомом железа — простого вещества. Найдите массовую долю соли в полученном растворе.
Элементы ответа:
1. Записаны уравнения реакций:
(1) Fe + 6HNO3 = Fe(NO3)3 + 3NO2 + 3H2O
(2) Fe3O4 + 10HNO3 = 3Fe(NO3)3 + NO2 + 5H2O
2. Вычислено количество исходных веществ
Fe0 − 3ē = Fe+3 в реакции [1]
Fe+2 − 1ē = Fe+3 в реакции [2]
n[1]ē : n[2]ē = 1 : 2, значит n(Fe) : n(Fe3O4) = 1 : 6
Пусть n(Fe) = x моль, тогда n(Fe3O4) = 6x моль, отсюда
56x + 232 · 6х = 144,8
х = 0,1
n(Fe) = 0,1 моль, n(Fe3O4) = 0,6 моль
3. Вычислена масса нитрата железа (III) в растворе
n1(Fe(NO3)3) = n(Fe) = 0,1 моль
n2(Fe(NO3)3) = 3 · n(Fe3O4) = 3 · 0,6 = 1,8 моль
mобщ.(Fe(NO3)3) = M · n = 242 · (0,1 + 1,8) = 459,8 г
4. Вычислена массовая доля нитрата железа (III)
n1(NO2) = 3 · n(Fe) = 0,3 моль
n2(NO2) = n(Fe3O4) = 0,6 моль
m(общ)(NO2) = n(общ) · M = (0,3 + 0,6) · 46 = 41,4 г
m(конеч. р-ра) = m(р-ра)(HNO3) + m(Fe) + m(Fe3O4) − m(общ)(NO2)
m(конеч. р-ра) = 900 + 144,8 − 41,4 = 1003,4 г
ω(Fe(NO3)3) = 459,8 : 1003,4 · 100 % = 45,82 %
| № | Ваш ответ | Ответ и решение | Первичный балл |
|---|---|---|---|
|
Здесь появится результат первой части. Нажмите на кнопку «Завершить работу», чтобы увидеть правильные ответы и посмотреть решения. |
|||